-
新型冠状病毒是一种致病性很强的 RNA 病毒,下列说法错误的是
A.新型冠状病毒组成元素中含有 C、H、O
B.用“84 消毒液”进行消毒时,消毒液越浓越好
C.3M 防颗粒物口罩均使用 3M 专有高效过滤材料——聚丙烯材质,聚丙烯属于高分子
D.不去人群聚集处、勤洗手可预防新型冠状病毒
难度: 中等查看答案及解析
-
下列关于古籍中的记载说法正确的是
A.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟 起,乃真硝石也”,该方法应用了显色反应
B.氢化钙的电子式是:Ca2+[∶H]2 –
C.目前,元素周期表已经排满,第七周期最后一种元素的原子序数是 118
D.直径为 20nm 的纳米碳酸钙属于胶体
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L 乙烷中所含的极性共价键数目为 7NA
B.某温度下,将 1molCl2 通入足量水中转移电子数为 NA
C.常温常压下,3.0 g 含葡萄糖的冰醋酸中含有的原子总数为 0.4NA
D.室温下,1LpH 为 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-个数为 0.01NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.Fe3+、SCN-、NO3-、Cl-可以大量共存
B.某碱溶液中通入少量 CO2 产生白色沉淀,该碱一定是 Ca(OH)2
C.Na[Al(OH)4]溶液和 NaHCO3 溶液混合可以产生白色沉淀和无色气体
D.少量的 Mg(HCO3)2 溶液加过量的 Ba(OH)2 溶液的离子方程式为:Mg2++2HCO3-+2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,其中 X 原子的质子总数与电子 层数相等,X、Z 同主族,Y、W 同主族,且 Y、W 形成的一种化合物甲是常见的大气污 染物。下列说法正确的是
A.简单离子半径:Z<Y<W<Q
B.Y 能分别与 X、Z、W 形成具有漂白性的化合物
C.非金属性:W<Q,故 W、Q 的氢化物的水溶液的酸性:W<Q
D.电解 Z 与 Q 形成的化合物的水溶液可制得 Z 的单质
难度: 中等查看答案及解析
-
洛匹那韦是一种 HIV-1 和 HIV-2 的蛋白酶的抑制剂, 下图是洛匹那韦的结构简式,下列 有关洛匹那韦说法错误的是

A.在一定条件下能发生水解反应 B.分子中有四种含氧官能团
C.分子式是 C37H48N4O4 D.分子间可形成氢键
难度: 中等查看答案及解析
-
利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是
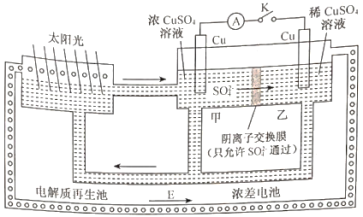
A. 循环物质E为水
B. 乙池中Cu电极为阴极,发生还原反应
C. 甲池中的电极反应式为Cu2++2e-=Cu
D. 若外电路中通过1mol电子,两电极的质量差为64g
难度: 中等查看答案及解析
-
下列实验中,依据实验操作及现象得出的结论正确的是
选项
操 作
现 象
结 论
A
向 3ml0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液
先出现白色沉 淀后出现黄色 沉淀
Ksp(AgCl)>Ksp(AgI)
B
将某气体通入品红溶液
品红溶液褪色
该气体是 SO2
C
用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH
后者 pH比前者 的小
非金属性:Cl>C
D
将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中
溶液变蓝
氧化性Fe3+>Cu2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
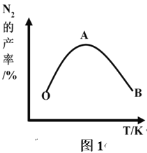
氮及其化合物的转化过程如图所示。下列分析不合理的是
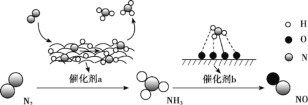
A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.催化剂不能改变反应焓变但可降低反应活化能
C.在催化剂 b 表面形成氮氧键时,涉及电子转移
D.催化剂 a、b 能提高反应的平衡转化率
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中
假设容器体积不变,固体试样体积忽略不计
,使其达到分解平衡:
。实验测得不同温度下的平衡数据列于下表:
温度
平衡气体总浓度
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应
、
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算
时的分解平衡常数约为
难度: 中等查看答案及解析
-
扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )
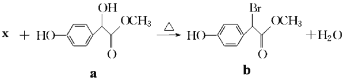
A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
难度: 中等查看答案及解析
-
常温下,用0.1 mol·L−1盐酸滴定10.0 mL浓度为0.1 mol·L−1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是

A.Ka2(H2A)的数量级为10−9
B.当V=5时:c(A2−)+c(HA−)+c(H2A)=2c(Cl−)
C.NaHA溶液中:c(Na+)>c(HA−)>c(A2−)>c(H2A)
D.c点溶液中:c(Na+)>c(Cl−)>c(H+)=c(OH−)
难度: 困难查看答案及解析
-
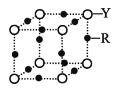
利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)

A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
难度: 中等查看答案及解析
-
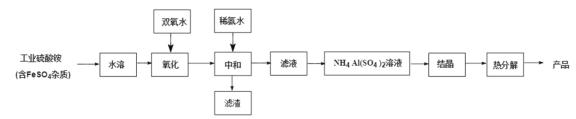
亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )

A.可将B中的药品换为浓硫酸
B.实验开始前通一段时间CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A中会有少量红棕色气体
D.装置D中溶液完全褪色后再停止滴加稀硝酸
难度: 中等查看答案及解析


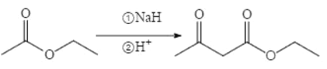 ,设计由乙醇和
,设计由乙醇和