-
下列有关我国最新科技成果的说法中错误的是
A.北斗卫星的太阳能电池板可将太阳能直接转化为电能
B.国产飞机——C919使用的航空煤油可从石油中分馏得到
C.高铁“复兴号”使用的碳纤维属于有机非金属材料
D.极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀
难度: 中等查看答案及解析
-
下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
难度: 中等查看答案及解析
-
已知:CH3CH(OH)CH2CH
CH3CH=CHCH3+H2O,下列有关说法正确的是
A.CH3CH=CHCH3分子中所有碳原子不可能处于同一平面
B.CH3CH=CHCH3和HBr加成产物的同分异构体有4种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与乙二醇、丙三醇互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列实验操作能达到相应实验目的的是
实验操作或实验操作与现象
实验目的或结论
A
将潮湿的氨气通过盛有无水氯化钙的干燥管
干燥氨气
B
向10%蔗糖溶液中加入稀硫酸,加热,再加入少量新制氢氧化铜悬浊液,加热,未出现砖红色沉淀
蔗糖未水解
C
向FeCl3,CuCl2的混合溶液中加入足量铁粉,然后过滤
提纯FeCl3
D
常温下,测定等浓度的NaClO4和Na2CO3溶液的pH
验证非金属性:C1>C
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
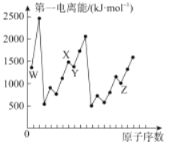
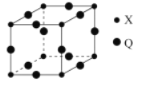
已知X、Y、Z、W为原子序数依次增大的短周期元素,Y、W为同一周期元素且W原子的最外层电子数等于Y原子的核外电子总数,其形成的一种化合物结构如图所示,下列叙述正确的是

A.原子半径:W>Z>Y>X
B.该化合物中各元素的原子最外层均满足8电子结构
C.X与Y形成的二元化合物常温下一定为气态
D.X、Y、Z、W可形成原子个数比8:1:2:3的化合物
难度: 中等查看答案及解析
-
科学家最近采用碳基电极材料设计了一种新的工艺方案消除甲醇对水质造成的污染,主要包括电化学过程和化学过程,原理如图所示,下列说法错误的是
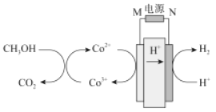
A.M为电源的正极,N为电源负极
B.电解过程中,需要不断的向溶液中补充Co2+
C.CH3OH在溶液中发生6Co3++CH3OH+H2O===6Co2++CO2↑+6H+
D.若外电路中转移1mol电子,则产生的H2在标准状况下的体积为11.2L
难度: 中等查看答案及解析
-
室温下,分别用0.1000mol•L-1的NaOH标准液滴定浓度均为0.1mol•L-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是
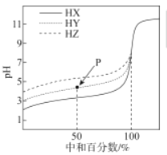
A.三种酸的酸性强弱:HX>HY>HZ
B.等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性
C.用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂
D.滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)
难度: 中等查看答案及解析
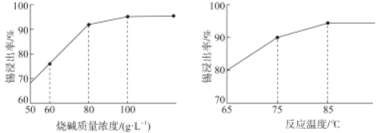
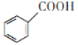 )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(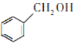 )的实验流程:
)的实验流程: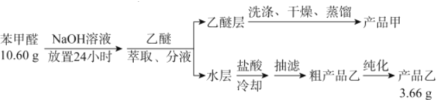
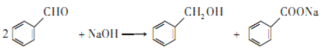 ;
;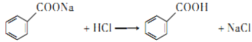 ;
;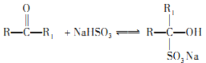 (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)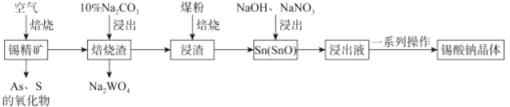

 R-CH2NH2(R表示坯基);
R-CH2NH2(R表示坯基);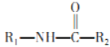 +C2H5OH(R表示烃基或氢原子)。
+C2H5OH(R表示烃基或氢原子)。