-
锡酸钠(Na2SnO3·xH2O)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,—种由锡精矿制备锡酸钠的工艺流程如下:
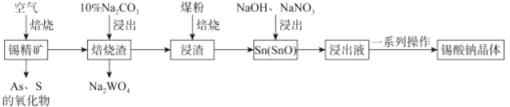
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3•xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为_____________。
(2)从“焙烧渣”中除去Fe3O4最简单的方法为_____________。加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO。在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___________________。
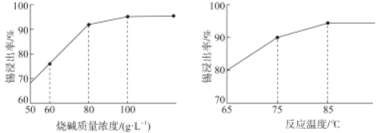
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为_____________、___________,
(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___________、洗涤、干燥。
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为__________。
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为______________。
-
锡酸钠(Na2SnO3)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,一种由锡精矿制备锡酸钠的工艺流程如图:
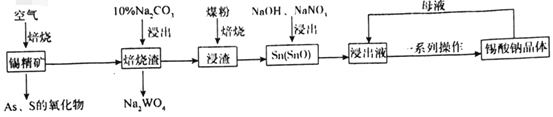
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②锡酸钠易溶于水,其溶解度随着温度的升高而降低。
请回答下列问题:
(1)Na2SnO3中锡元素的化合价为___,从焙烧渣中除去Fe3O4最简单的方法为___。
(2)WO3与Na2CO3溶液反应生成Na2WO4的化学方程式为___。
(3)加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___。
(4)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH的质量浓度和反应时间的关系图,则“碱浸”时最适宜条件为___、___。

(5)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___,将母液返回至浸出液的目的为___。
(6)碱性镀锡以NaOH和Na2SnO3为电解液,以纯锡为阳极材料,待镀金属为阴极材料,镀锡时阳极反应的电极反应式为___。
-
四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。
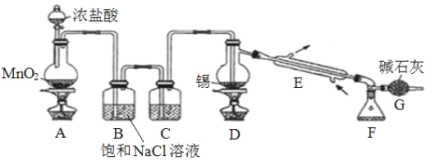
已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
| 物质 | 颜色 | 熔点/℃ | 沸点/℃ |
| Sn | 银白色 | 232 | 2260 |
| SnCl2 | 白色 | 247 | 652 |
| SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
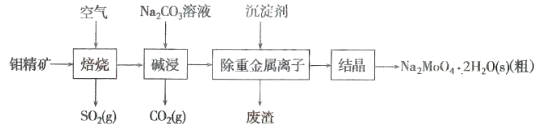
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
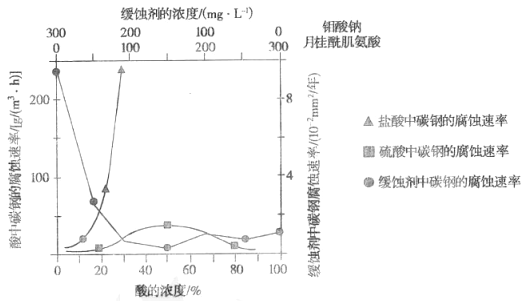
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
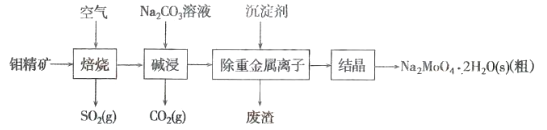
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
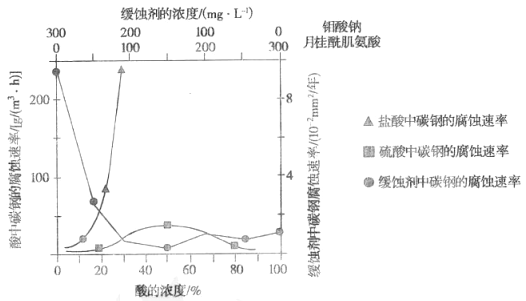
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
 用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上
用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上 的制备路线如图:
的制备路线如图:
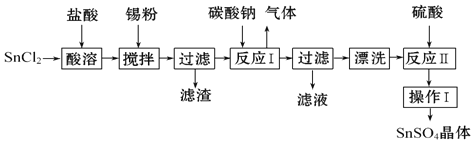
已知:
Ⅰ 酸性条件下,锡在水溶液中有
酸性条件下,锡在水溶液中有 、
、 两种主要存在形式,
两种主要存在形式, 易被氧化.
易被氧化.
Ⅱ 易水解生成碱式氯化亚锡.
易水解生成碱式氯化亚锡.
回答下列问题:
 锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是______.
锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是______.
 操作Ⅰ是______、______、过滤、洗涤.
操作Ⅰ是______、______、过滤、洗涤.
 粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:______.
粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:______.
 加入锡粉的作用有两个:
加入锡粉的作用有两个: 调节溶液pH,
调节溶液pH, ______.
______.
 反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______.
反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______.
 酸性条件下,
酸性条件下, 还可以用作双氧水去除剂,发生反应的离子方程式是______.
还可以用作双氧水去除剂,发生反应的离子方程式是______.
 该小组通过下列方法测定所用锡粉的纯度
该小组通过下列方法测定所用锡粉的纯度 杂质不参与反应
杂质不参与反应 :
:
 将试样溶于盐酸中,反应为
将试样溶于盐酸中,反应为 ;
;
 加过量
加过量 氧化
氧化 生成
生成 ;
;
 用已知浓度的盐酸酸化过的
用已知浓度的盐酸酸化过的 滴定生成的
滴定生成的 ,反应的化学方程是:
,反应的化学方程是:
取 锡粉,经上述各步反应后,共用去
锡粉,经上述各步反应后,共用去 溶液
溶液 ,则锡粉中锡的质量分数是______。保留一位小数
,则锡粉中锡的质量分数是______。保留一位小数
-
钼(Mo)是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
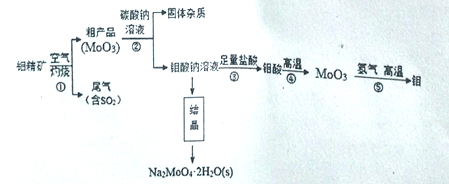
(1)Na2MoO4·2H2O中钼元素的化合价是_______,结晶得到的钼酸钠晶体时粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______(填序号)。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_________。能提高该反应速率的措施有______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式___________。
(6)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,c(CO32-)=0.52mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的去除率为______。[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
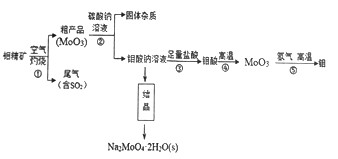
(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
-
锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
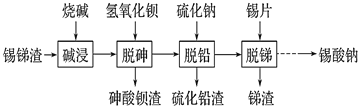
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
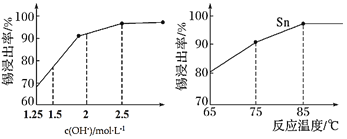
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
-
锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:

请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
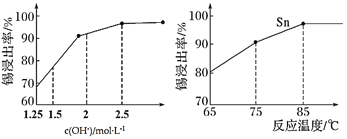
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。















