-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
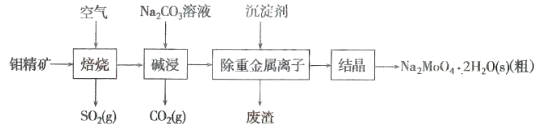
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
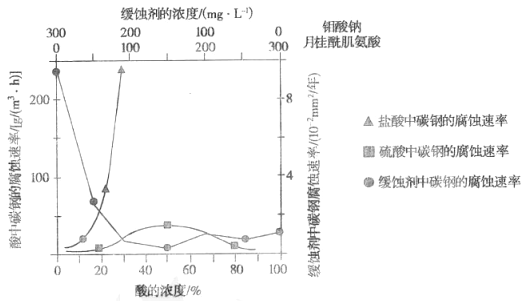
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
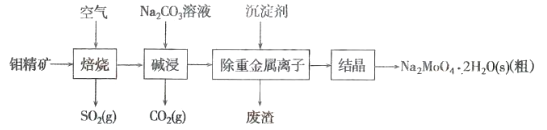
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
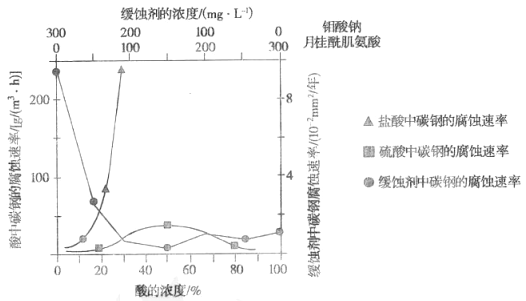
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
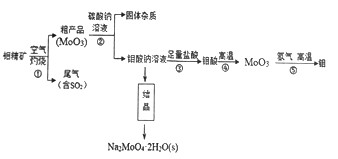
(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
-
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
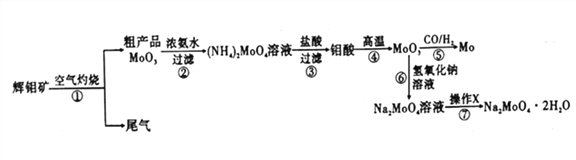
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
-
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
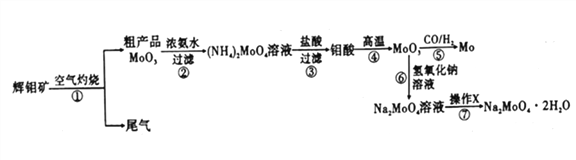
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
-
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
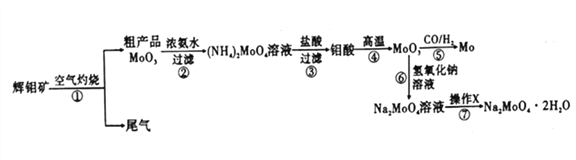
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
-
钼(Mo)是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
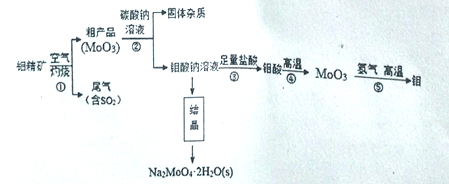
(1)Na2MoO4·2H2O中钼元素的化合价是_______,结晶得到的钼酸钠晶体时粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______(填序号)。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_________。能提高该反应速率的措施有______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式___________。
(6)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,c(CO32-)=0.52mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的去除率为______。[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
-
钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
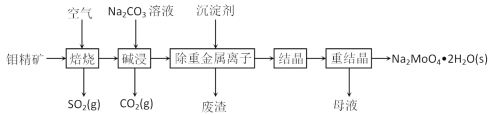
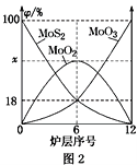
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕
-
钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
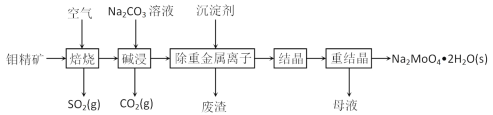
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
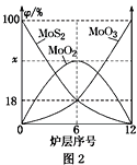
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕
-
钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(l)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为____。在碱性条件下,将钼精矿(主要成分为MoS2)加入NaClO溶液中,也可以制备钼酸钠,该反应的离子方程式为________。
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=_________(用含△H1、△H2的代数式表示)。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。

图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是____(填序号)。
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=__(已知A点压强为0.lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是____(填“A”或“B”),T1对应的平衡常数为____。






 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。




