-
在电影《我和我的祖国》之《前夜》中有这一场景,升旗杆上阻断球锈断,林治远工程师向原材料中加入铬和镍形成不锈钢,赶制出新的阻断球。不锈钢是常见的合金。关于合金,下列说法不正确的是
A.多数合金熔点低于其组分中任意一种组成金属的熔点
B.人类使用最早的合金是青铜
C.钠钾合金是原子反应堆的导热剂
D.目前世界上使用量最大的合金是铝合金
难度: 中等查看答案及解析
-
已知NA为阿伏加德罗常数的值,下列说法正确的是
A.向FeI2溶液中通入适量Cl2,当有1mol Fe2+被氧化时,共转移的电子数为NA
B.3克由CO2和SO2组成的混合气体中含有的质子数为1.5NA
C.2.8g聚乙烯中含有的碳碳双键数目为0.1NA
D.1L0. lmol/L AlCl3溶液中所含Al3+的数目为0.1NA
难度: 中等查看答案及解析
-
有机化合物X的结构简式如图。下列有关该化合物说法正确的是
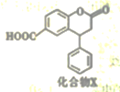
A.X的分子式为C16H11O4 B.X分子中有3种不同的官能团
C.lmol X能与8mol氢气发生加成反应 D.既能发生酯化反应,又能发生水解反应
难度: 中等查看答案及解析
-
从下列实验操作、现象得出的相应结论不正确的是
选项
实验操作
结论
A
向FeCl3和BaCl2混合溶液中通入足量SO2,溶液变为浅绿色,且有白色沉淀生成
Fe3+被还原为Fe2+,白色沉淀为BaSO4
B
氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色
说明氯水中有HClO存在
C
将淀粉与KCl混合液装入半透膜袋内,浸泡在盛蒸馏水的烧杯中,5min 后取烧杯中液体,加碘水变为蓝色
证明半透膜有破损
D
将气体通入盛饱和碳酸钠溶液的洗气瓶
可用于除去CO2中的HCl
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、U、W为原子序数依次增大的短周期主族元素,已知X、Y为同周期的相邻元素且形成的某种二元化合物能形成光化学烟雾,Z为金属元素且Z原子的L层电子数比其他各层上电子数之和大5, U的最高价与最低价的代数和为0,W的最高价氧化物对应水化物和其氢化物均为强酸。下列说法正确的是
A.原子半径大小: W>U>Z>Y>X
B.X、W不可能形成共价化合物
C.UY2可用于制光导纤维
D.Z单质在Y单质中燃烧生成白色固体
难度: 中等查看答案及解析
-
电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是
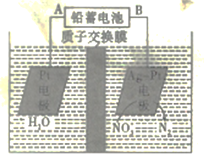
A.电源正极为B
B.H+由右侧通过交换膜移动到左侧
C.该电解池的阴极反应式为2NO3-+12H+ +10e-=N2↑+6H2O
D.标况下,若有2. 24LN2生成,理论上铅蓄电池中有20.7克Pb消耗
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
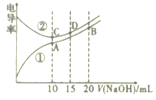
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
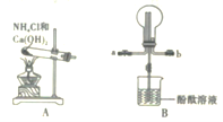

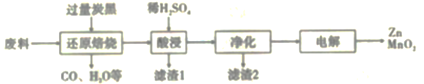

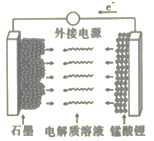

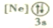 B.
B.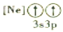 C.
C.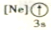 D.
D.
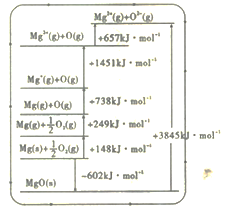
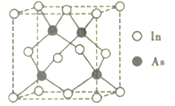
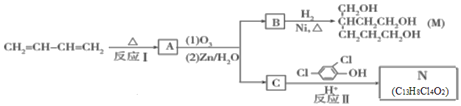
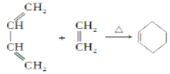
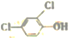 反应生成N。
反应生成N。