-
锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图:
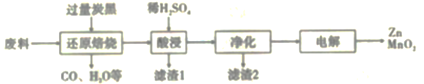
已知:Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
回答下列问题:
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为_____。
(2)滤渣1主要成分的化学式是________。
(3)净化阶段
①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。
A.氯水 B.O2 C.氨水 D.MnCO3
②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17。净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,调节pH的合理范围是______。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4。写出该反应的化学方程式:________。
(5)LiMn2O4材料常制作成可充电电池(如图),该电池的总反应为
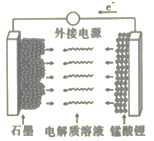
①充电时,锰酸锂为电池的_______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______________。
②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重____________。
-
Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:
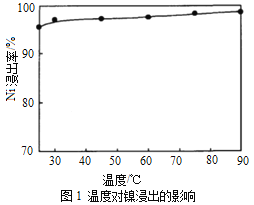
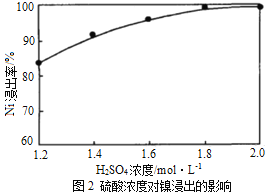
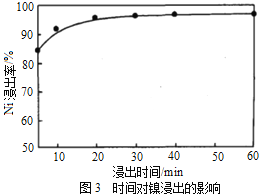
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF 可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2 的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示) 形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH 变化如图所示。试分析pH 增大时,锌的萃取率逐渐增大的原因是___________________。
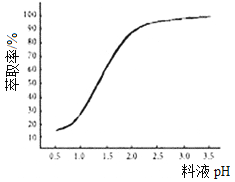
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg 含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O 1.686kg,则镍的回收率为_______________。
-
废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
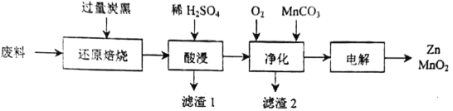
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
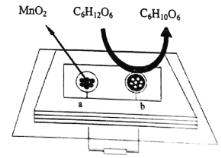
-
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
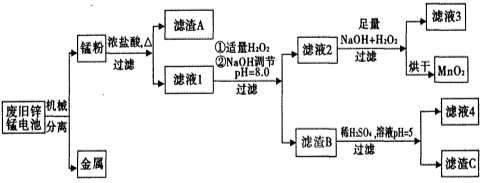
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___________________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)滤液1中加入H2O2的作用是________________________________________。
(3)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式_____________________________。
(5)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(6)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液阳极电极反应式为____________________。
-
市售一次性电池品种很多的,碱性锌锰电池的日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
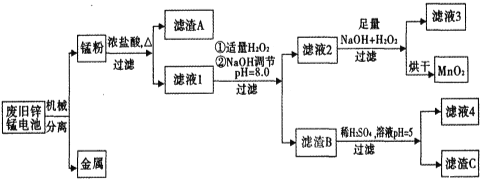
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含量有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表。
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0x10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___。计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=___。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式___。
(3)写出滤渣B与稀硫酸在pH=5时的化学方程式___。
(4)工艺中还可以将滤液4进行___、___、___、___、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4,在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式___。
-
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
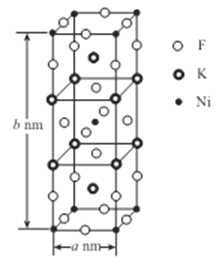
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
-
锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
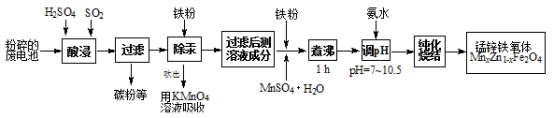
(1)酸浸废电池时,被溶解生成Zn2+的物质有 ,SO2的作用是 (填字母编号)。
A. 漂白剂 B. 沉淀剂 C. 氧化剂 D. 还原剂
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
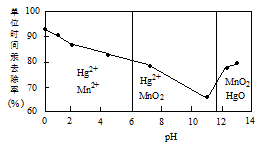
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)==2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)==MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是 。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为 。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O) kg。(只列出计算式)
-
锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
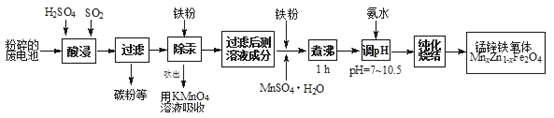
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
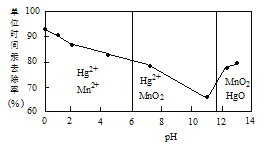
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
-
锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
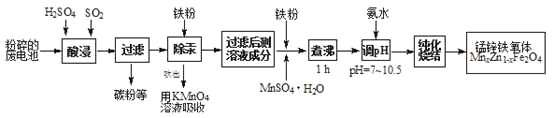
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
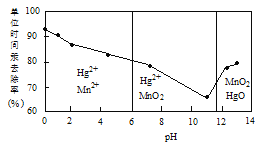
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
-
我国是最早发现并使用青铜器的国家,后母戊鼎是我国的一级文物,是世界上出土的最大最重的青铜礼器。现代社会中铜的应用常广泛,铜的回收再利用是化工生产的一个重要领域。实验室利用废旧电池的铜帽 、Zn总含量约为
、Zn总含量约为 回收Cu并制备ZnO的部分实验过程如下:
回收Cu并制备ZnO的部分实验过程如下:
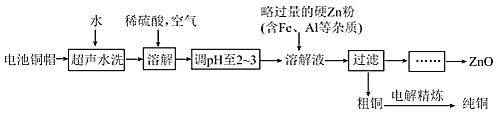
请回答下列问题:
(1)请写出一种加快铜帽溶解的方法:______。铜帽溶解时通入空气的作用是______ 用化学方程式表示
用化学方程式表示 。
。
(2)调节溶液pH时,是将溶液的pH调______ 填“大”或“小”
填“大”或“小” 到
到 。
。
(3)电解精炼粗铜时,阴极的电极反应式为______。工业上常釆用甲醇燃料电池作为电解精炼铜旳电源,写岀碱性甲醇燃料电池的负极反应式:______。
(4)已知: 吋,
吋, 能溶于 NaOH溶液生成
能溶于 NaOH溶液生成 。室温下,几种离子生成氢氧化物沉淀的pH如下表所小
。室温下,几种离子生成氢氧化物沉淀的pH如下表所小 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为 计算
计算 :
:
①表中 沉淀完全的pH为______。
沉淀完全的pH为______。
②由过滤粗铜的滤液制备ZnO的实验步骤依次为 可选用的试剂:
可选用的试剂: 、稀硝酸、
、稀硝酸、 溶液
溶液 :
:
 ______;
______;
 ______;
______;
 过滤;
过滤;
 ______;
______;
 过滤、洗涤、干燥;
过滤、洗涤、干燥;
 煅烧。
煅烧。



















