-
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
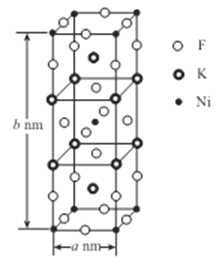
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
-
镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________,未成对电子数为________________。
(2)Ga(NO3)3中阴离子的立体构型是_____________,写出一个与该阴离子的立体构型相同的分子的化学式___________。
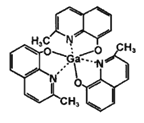
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________(填元素符号),提供孤电子对的成键原子是_____________。
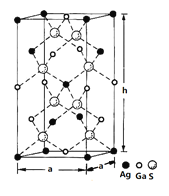
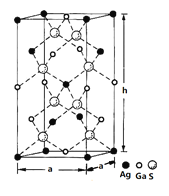
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________g·cm-3(列出计算式即可)。
-
镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________,未成对电子数为________________。
(2)Ga(NO3)3中阴离子的立体构型是_____________,写出一个与该阴离子的立体构型相同的分子的化学式___________。
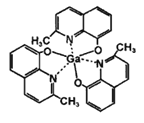
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________(填元素符号),提供孤电子对的成键原子是_____________。
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________g·cm-3(列出计算式即可)。
-
镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。已知砷化镓的晶胞结构如图。试回答下列问题:
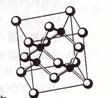
(1)下列说法不正确的是(选填序号)________。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:Se >As> Ge> Ga
C.镓、锗、砷、硒都属于p区元素
D.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3反应制备得到,该反应在700℃进行,反应的方程式为________ ,AsH3空间形状为 ________。
(3)Ge的核外电子排布式为 ________,H2 Se中硒原子的杂化方式为________。
(4)AsH3沸点比NH3低,其原因是:________。
-
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为_________________________________。
(2)沸点:NH3________AsH3(填“>”、“<”或“=”,原因是_____________________。
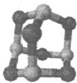
(3)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为_______,As原子采取__________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________。
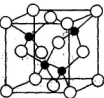
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为_________________;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm,则每立方厘米该晶体中所含砷元素的质量为____________g(用NA表示阿伏加德罗常数的值)。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
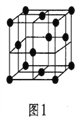
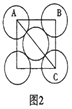
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)基态铁原子的价电子轨道表示式为__。铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为___。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgC1沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②H2O分子的VSEPR模型为___。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
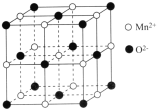
①该晶胞中由O2-形成的正八面体空隙数目为__。
②设NA为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=____g·cm-3。(用含a、NA的代数式表示)。
-
锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图:
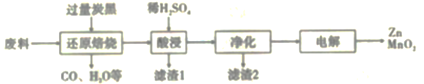
已知:Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
回答下列问题:
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为_____。
(2)滤渣1主要成分的化学式是________。
(3)净化阶段
①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。
A.氯水 B.O2 C.氨水 D.MnCO3
②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17。净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,调节pH的合理范围是______。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4。写出该反应的化学方程式:________。
(5)LiMn2O4材料常制作成可充电电池(如图),该电池的总反应为
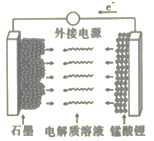
①充电时,锰酸锂为电池的_______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______________。
②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重____________。
-
铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
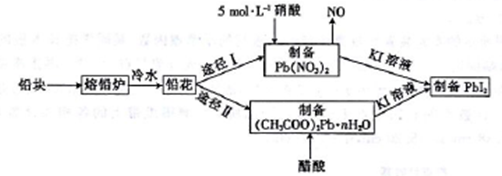
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
⑶写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
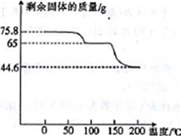
①(CH3COO)2Pb • nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。
-
铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
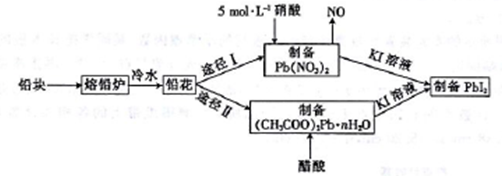
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
⑶写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
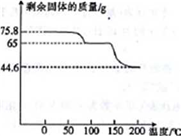
①(CH3COO)2Pb • nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。

















