-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
酸性:苯酚>HCO3-
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀
氯乙烷发生水解
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
结论
操作
A
CO32-水解是吸热反应
在0.1 mol/LNa2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深
B
Ksp(BaSO4)>Ksp(BaCO3)
常温下,用饱和Na2CO3溶液可将BaSO4全部转化为BaCO3
C
酸性A比B强
等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多
D
金属性:M>N
由M、N与稀硫酸构成的原电池中,M上产生大量气泡
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
基态X、Y、Z原子的核外电子排布式如下表,则下列化合物中不存在的是
基态原子的核外电子排布式
X
1S22S22P4
Y
1S22S22P63S1
Z
1S22S22P63S23P4
A.Y2ZX3 B.Y2X2 C.YZ D.ZX3
难度: 中等查看答案及解析
-
25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]-Ksp[Fe(OH)2],下列说法正确的是
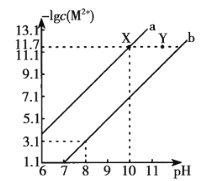
A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2 和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):c(Cu2+)= l:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
难度: 困难查看答案及解析
-
25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质
AgCl
AgBr
AgI
Ag2S
颜色
白
淡黄
黄
黑
Ksp
1.8×10-10
7.7×10-13
1.5×10-16
1.8×10-50
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
难度: 困难查看答案及解析
-
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
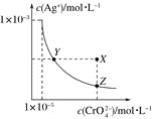
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
难度: 困难查看答案及解析
-
如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
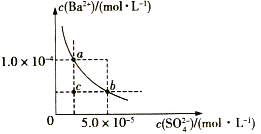
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
难度: 困难查看答案及解析
-
已知常温下Ksp(AgCl)=1.8×10-10mol2/L2,Ksp(AgI)=1.0×10-16 mol2/L2。下列说法中正确的是
A. 在相同温度下AgCl的溶解度小于AgI的溶解度
B. AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C. 常温下,AgC1若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11mol/L
D. 将足量的AgCl分别放入下列物质中:①20mL0.01mol/LKCl溶液 ②10mL0.02mol/LCaCl2溶液 ③30mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的顺序为: ③>②>①
难度: 困难查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42— B.CrO42—、Br-、Cl- C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
难度: 中等查看答案及解析
-
下列说法正确的是()
A.向 AgCl 、 AgBr 的饱和溶液中滴加少量 AgNO3 溶液,溶液中
不变
B.向0.1mol L1 的CH3COOH 溶液中加入少量水,溶液中
减小
C.0.1mol K2Cr2O7 被完全还原为Cr3 时,转移的电子数约为1.806 1023
D.一定条件下,反应 2NO(g) 2CO(g) N 2(g) 2CO 2(g) 能自发进行,该反应的ΔH>0
难度: 中等查看答案及解析
-
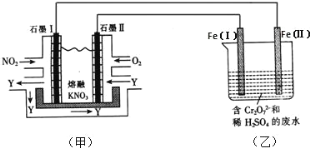
电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
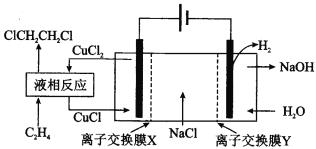
A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl
H2 + 2NaOH + ClCH2CH2Cl
难度: 中等查看答案及解析
-
某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
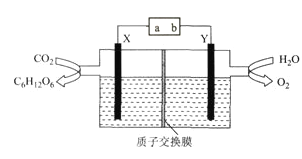
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
难度: 中等查看答案及解析
-
硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
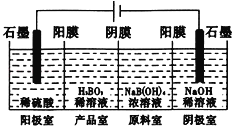
A.当电路中通过1mol电子时,可得到lmolH3BO3
B.将电源的正负极反接,工作原理不变
C.阴极室的电极反应式为:2H2O-4e-=O2+4H+
D.B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
难度: 中等查看答案及解析
-
二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
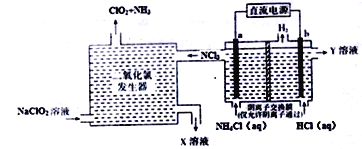
下列说法不正确的是
A.b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B.二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C.电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D.电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
难度: 中等查看答案及解析
-
用石墨电极完成下列电解实验
实验一
实验二
装置
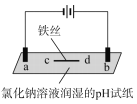

现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生……
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH- B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+ D.根据实验一的原理,实验二中m处能析出铜
难度: 中等查看答案及解析
-
下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质所形成的化学电源;乙利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是
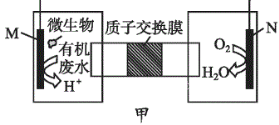
A.甲中H+透过质子交换膜由左向右移动
B.乙池中Fe棒应与甲池中的M极相连
C.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D.若溶液中减少了0.0lmolCr2O72-,则电路中至少转移了0.12 mol电子
难度: 中等查看答案及解析
-
高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
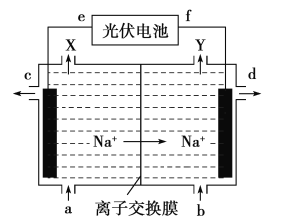
A.上述装置中,f极为光伏电池的正极
B.阴极的电极反应为2H2O-4e- =4H++O2↑
C.d处得到较浓的NaOH 溶液,c处得到HClO4
D.若转移2mol电子,理论上生成100.5gHClO4
难度: 中等查看答案及解析
-
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
难度: 中等查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.当有0.8mol电子转移时,b极产生4.48LO2
B.为了增加导电性可以将左边容器中的水改为NaOH溶液
C.d极上发生的电极反应是:2H+ +2e-=H2
D.c极上进行氧化反应,A池中的H+可以通过隔膜进入B
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列说法正确的是()
A.电解精炼铜,当外电路通过 NA 个电子时,阳极质量减小 32 g
B.反应 3H2(g)+N2(g)
2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
C.常温常压下 27 克 Al 与 33.6L 氯气完全反应,电子转移数小于 3NA
D.1 mol·L-1 氯化铜溶液中,若 Cl-的数目为 2NA,则 Cu2+的数目略小于 NA
难度: 中等查看答案及解析
-
新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )
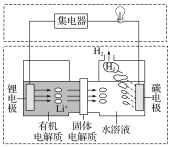
A.碳极发生的反应:2H2O+2e-=H2↑+2OH-
B.有机电解质和水溶液不可以互换区域
C.理论上外电路中每转移1 mol电子,负极消耗的质量为7 g
D.若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极
难度: 中等查看答案及解析
-
具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是( )
A.两原子核外全部都是s电子
B.最外层电子排布为3s23p6的原子和最外层电子排布为3s23p6的离子
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子
D.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
难度: 困难查看答案及解析
-
下列表示钠原子的式子中能反映能级差别和电子自旋状态的是()
A.
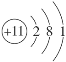
B.
C.1s22s22p63s1
D.
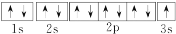
难度: 中等查看答案及解析
-
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物
,Z元素可形成负一价离子。下列说法正确的是( )
A.X元素原子的基态电子排布式为
B.X元素是第四周期第ⅤA族元素
C.Y元素原子的电子排布图为
D.Z元素的单质
在氧气中不能燃烧
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:

难度: 简单查看答案及解析