-
通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈________性(填“酸”、“中”或“碱”),原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________,原因是________________________________________________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为_______________________________。
(4)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
-
通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
-
从宏观现象探究微观本质是重要的化学学科素养。以亚硫酸纳(Na2SO3)为实验对象,探究其性质。实验如下:
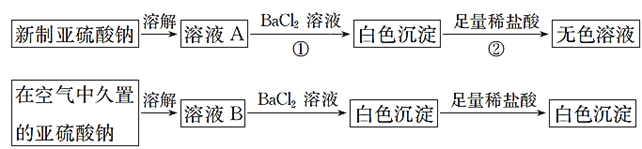
(1)写出上述实验中②的离子方程式:__________。
(2)通过上述实验可知,在空气中久置的亚硫酸纳固体中会混有____________ (填化学式)。
(3)亚硫酸纳晶体样品若变质,下列说法错误的是 _______________。
A.晶体表面变黄 B.其水溶液pH 将减小 C.其样品质量将增加
(4)将碳酸纳溶液加热到40 ℃通入二氧化硫饱和后,再加入等量的碳酸钠溶液,在避免与空气接触的情况下结晶可制得亚硫酸钠,该制备过程总反应的化学方程式 ___________。
-
将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是________
(2)最后一个离子反应的离子方程式是________
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式:________。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:________。
-
卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
| 氟 | 氯 | 溴 | 碘 |
| 第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
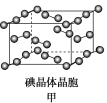
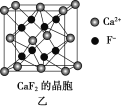
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
-
氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g) △H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
| 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性: H2SeO4_____H2SeO3 (填“<”或“ >”)。
(6)S的常见单质S8的结构为 ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
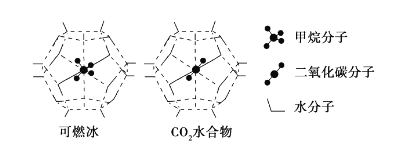
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示) 的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。
-
卤族元素的单质和化合物很多我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的________区;溴的价电子排布式为________;
(2)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(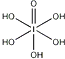 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
(4) 与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列________式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,氯原子的杂化轨道类型为________,与ClO2-互为等电子体的微粒是________。(任写一个)
(6)下图为碘晶体晶胞结构.有关说法中正确的是________
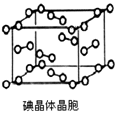
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
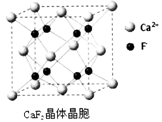
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为________。
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、 、 。(填写微粒符号)
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3、②NaCl、③NaClO、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为 。(填写溶液的序号)
(3)常温时,AlCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl、② (NH4)2SO4、 ③NH3·H2O ④ (NH4)2CO3 、⑤ NH4HSO4。溶液中c(NH4+)从大到小的顺序为: 。(填写溶液的序号)
-
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ________ ②________ ________ 。
(2)溶液中共有________种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是:________ 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为________。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为________(用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为________(填序号),溶液②中c(Cl-)=________。
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。




 ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
