-
下列反应属于取代反应的是( )
A. 苯与液溴在铁粉存在下反应
B. 在镍做催化剂的条件下,苯与氢气反应
C. 乙烯的燃烧
D. 乙烯通入酸性高锰酸钾溶液中
难度: 简单查看答案及解析
-
用标准氢氧化钠滴定未知浓度的盐酸,选用酚酞作为指示剂,下列操作会使滴定结果偏低的是
A. 用蒸馏水洗净滴定管后,装入标准氢氧化钠溶液进行滴定
B. 盛装标准液的碱式滴定管滴定前有气泡,滴定后气泡消失
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D. 盛装标准液的碱式滴定管滴定前仰视,滴定后俯视
难度: 中等查看答案及解析
-
下列关于化学用语表达正确的是( )
A.
的电子式为
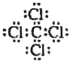 B.
B.的电子式为
C.
的电子式为
D.乙烯的结构式:
难度: 简单查看答案及解析
-
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH=1.9 kJ·mol”可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ/mol
D.在稀溶液中:H++OH-=H2O ΔH=-57.3 kJ·mol ,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ
难度: 中等查看答案及解析
-
已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O
HCl+HClO;HClO
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2 B.NaHCO3 C.HCl D.NaOH
难度: 中等查看答案及解析
-
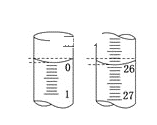
用下列装置进行实验,能达到实验目的的是( )
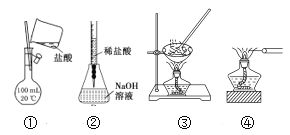
A.①配制250mL 0.1mol/L的盐酸 B.②用稀盐酸滴定氢氧化钠溶液
C.③海带灼烧成灰 D.④鉴别KNO3溶液和NaCl溶液
难度: 简单查看答案及解析
-
下列离子方程式中,属于水解反应且正确的是的是( )
A.HCOOH+OH-
HCOO—+H2O B.CO2+H2O
+H+
C.
+H2O
+OH- D.HS—+H2O
S2—+H3O+
难度: 中等查看答案及解析
-
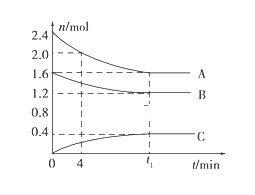
已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A.
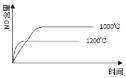
B.
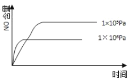
C.
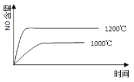
D.
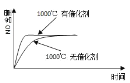
难度: 中等查看答案及解析
-
分子式为C4H8Cl2的有机物共有(不含立体异构)
A. 7种 B. 8种 C. 9种 D. 10种
难度: 简单查看答案及解析
-
在一定温度下,固定容积的密闭容器中发生反应A(g)+3B(g)⇌2C(g)+2D(s),下列叙述不是反应达到平衡状态标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C、D的分子数之比为1∶3∶2∶2
A. ②⑧ B. ②⑤⑧
C. ①③④⑦ D. ②⑤⑥⑧
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是( )
A.0.1mol/L CH3COOH溶液的pH>1:CH3COOH
CH3COO-+H+
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)
N2O4(g) △H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:
+H2O
+OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A.c(H+)=
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
难度: 中等查看答案及解析
-
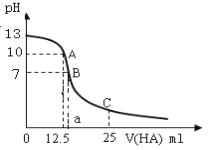
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是
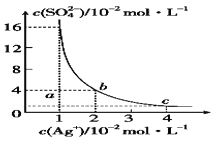
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的Ksp=1.6×10-5
D.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
难度: 中等查看答案及解析
-
如图为纳米二氧化锰燃料电池,其电解质溶液呈酸性,已知(CH2O)n中碳的化合价为0价,有关该电池的说法正确的是( )
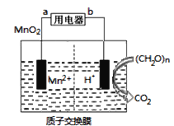
A.放电过程中左侧溶液的pH降低
B.当产生22gCO2时,理论上迁移质子的物质的量为4mol
C.产生22gCO2时,膜左侧溶液的质量变化为:89g
D.电子在外电路中流动方向为从a到b
难度: 中等查看答案及解析