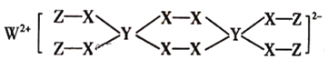-
人类在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是:
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
难度: 简单查看答案及解析
-
工业制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)=Si(s)+ 4HCl(g)△H=QkJ•mol-1(Q>0)。在一定某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应,下列叙述错误的是
A.反应过程中,若充入一定量NH3,可能提高SiCl4的转化率
B.若反应开始时加入1mol SiCl4,则达到平衡时,.吸收热量小于Q kJ
C.反应至4min时,若HCl浓度为0.12 mol•L-l,H2的反应速率为0.03 mol•L-1•min-1
D.当反应吸收热量为0.025QkJ时,生成的 HC1 恰好中和 0.l molNaOH
难度: 简单查看答案及解析
-
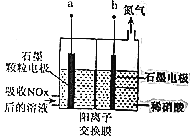
石墨烯是新一代防腐材料,它不仅具有可以阻隔几乎所有气体的完美屏蔽性能,而且还是目前世界最薄最坚硬的纳米材料之一。下列说法错误的是
A.金属腐蚀是金属被氧化的过程
B.石墨烯结构中最小环由六个碳原子构成
C.石墨烯是一种新型的复合材料
D.金属表面进行石墨烯防腐处理后,石墨烯层破损会加速金属腐蚀进程
难度: 简单查看答案及解析
-
下列元素原子结构的最外层电子排布中,元素属于副族元素的是
A.3s33p3 B.3d104s1 C.3d64s2 D.2s22p4
难度: 简单查看答案及解析
-
X、Y、Z表示三种元素的原子,其最外层电子排布分别为ns1、3s23p4和2s2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.XYZ3 C.X2Y2Z3 D.X3YZ4
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A.39g苯蒸气含碳碳双键的数目为1.5NA
B.将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C.高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.45NA
D.电解饱和食盐水消耗2molNaCl,加入含2mol HCl的盐酸可恢复到电解前的状态
难度: 简单查看答案及解析
-
由多元素组成的化合物Fe-Sm-As-F-O是一种重要的铁系超导材料。下列说法正确的是
A.F的核外电子排布式1s22s22p7
B.Fe3+的轨道表示式
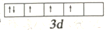 违背了泡利不相容原理
违背了泡利不相容原理C.N、As同主族,第一电离能N<As
D.电负性F>O>As
难度: 简单查看答案及解析
-
下表中的实验、现象和解释对应都正确的是
选项
实验
现象
解释
A
向CuSO4溶液中通入H2S气体
无明显现象
弱酸不能制强酸
B
用玻璃杯分别蘸取NaClO溶液和CH3COONa溶液滴在pH试纸上,在空气中久置
CH3COONa溶液的试纸为蓝色,NaClO溶液的试纸为无色
HClO酸性强于
CH3COOH
C
向0.1mol/L的Fe(NO3)2溶液
中滴加盐酸
振荡试管溶液颜色变为黄色
Fe2+被氧化为Fe3+
D
向5mL0.1mol/LAgNO3溶液滴入3滴0.1mol/LNaBr溶液,再滴加0.1mol/LNaCl溶液
先有浅黄色沉淀生成,后又生成白色沉淀
AgBr的溶度积
比AgCl的大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
元素X、Y、Z、M在周期表中的相对位置如图所示,已知M元素原子的价电子排布式ns2pn+1,且最外层有9个原子轨道。下列说法错误的是
X
Y
M
Z
A.M元素原子的价电子排布为3s23p4
B.Y元素在周期表的第四周期第VA族
C.X基态原子核外有两个未成对电子
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p2
难度: 简单查看答案及解析
-
下列关于溶液的说法中正确的是
A.pH=7的溶液中,Na+、NH4+、CH3COO-、NO3-可以大量共存
B.Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9,任何条件下二者不可能相互转化
C.1mol/LNa2SO4溶液中阴离子数目大于1mol/LNa2CO3溶液中阴离子数目
D.Na2S溶液与FeC13溶液混合后产生沉淀,该沉淀一定是Fe(OH)3
难度: 简单查看答案及解析
-
合金ThNi5可催化反应CO(g)+3H2(g)=CH4(g)+H2O(g),在一定温度下,反应过程中有无催化剂的能量变化如图。下列叙述正确的是
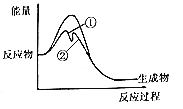
A.使用催化剂时反应的速率主要决定于第②步
B.缩小体积可加快该反应速率,是因为增大了活化分子百分数
C.使用催化剂降低反应的焓变,降低温度有利于产物的生成
D.升高温度,平衡常数减小
难度: 中等查看答案及解析
-
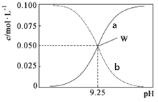
某温度下,分别在下列容积为2L的恒容绝热密闭容器中,发生如下反应: 2CO(g)+SO2(g)=S(g)+2CO2(g) △H>0。测得相关数据如下表所示。
容器
起始时物质的量
平衡时CO(g)的浓度/mol·L
CO(g)
SO2(g)
S(g)
CO2(g)
甲
1
0.5
0.5
1
a
乙
1
0.5
0
0
0.2
丙
0
0
1
2
b
下列说法正确的是
A.平衡常数:K甲>K乙
B.a=0.4
C.若乙容器l0min达到平衡.则用S(g)表示的反应速率为0.005mol•L-1•min-1
D.若将丙容器改为恒压绝热容器,则达到平衡时b=0.2
难度: 困难查看答案及解析