-
中国独创最大钻井平台“蓝鲸二号”助力“可燃冰”开采。下列关于“可燃冰”的说法错误的是
A.是巨大的潜在能源
B.是一种配合物
C.属于分子晶体
D.其中存在氢键
难度: 简单查看答案及解析
-
下列分子或离子的VSEPR模型与空间立体构型一致的是
A.BF3 B.NH3 C.H2O D.ClO3-
难度: 简单查看答案及解析
-
处于基态的下列微粒,核外电子中未成对电子数最多的是
A.O B.P C.Cr D.Fe3+
难度: 简单查看答案及解析
-
下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是
A.石墨转变为金刚石的反应是吸热反应

B.白磷比红磷稳定

C.S(g)=S(s) ΔH>0

D.H2(g)+I2(g)
2HI(g) ΔH>0

难度: 简单查看答案及解析
-
我国的超级钢研究居于世界领先地位。某种超级钢中除Fe外,还含Mn 10%、C 0.47%、Al 2%、V 0.7%。下列说法中错误的是
A.上述五种元素中,有两种位于周期表的p区
B.超级钢的晶体一定是金属晶体
C.X-射线衍射实验可以确定超级钢的晶体结构
D.超级钢中存在金属键和离子键
难度: 简单查看答案及解析
-
某同学在实验报告中记录了下列数据,其中正确的是
A.用托盘天平称取5.85 g食盐
B.用10 mL量筒量取7.35 mL盐酸
C.用pH计测出某溶液pH为3.52
D.从碱式滴定管放出酸性KMnO4溶液15.60 mL
难度: 简单查看答案及解析
-
对下列实验事实的理论解释错误的是
选项
实验事实
理论解释
A
碘单质在苯中溶解度比在水中大
苯和I2都是非极性分子,而H2O是极性分子
B
Be单质能溶于KOH溶液
Be和Al在周期表中是对角线关系,性质相似
C
酸性:H2SO4>H2SO3
H2SO4非羟基氧原子个数大于H2SO3,中心原子正电性越高,酸性越强
D
SiO2的熔点高于CO2
SiO2相对分子质量比CO2大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列叙述错误的是
A.金属晶体中,六方最密堆积的空间利用率大于面心立方最密堆积
B.由于ZnS的晶格能大于PbS的晶格能,所以岩浆冷却时ZnS先析出
C.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
D.AgCl沉淀不溶于硝酸,但能溶于氨水
难度: 简单查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期元素,它们原子的最外层电子数之和为18。W的族序数是周期数的2倍,X与W位于相邻主族,Y的最外层电子数等于X的次外层电子数。下列说法正确的是
A.原子半径:Z>Y>X B.气态氢化物的热稳定性:W>X
C.Y与Z可形成离子化合物 D.Z的氧化物的水化物均为强酸
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A.含28 g硅的SiO2晶体中存在的共价键总数为2NA
B.标准状况下,2.24 L乙烯中含有的π键数目为0.1NA
C.室温时,pH=2的盐酸中H+ 数目为1.0×10-2NA
D.124 g P4(正四面体)中P-P键数目为4NA
难度: 简单查看答案及解析
-
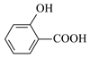
下列物质的性质比较,结论错误的是
A.硬度:金刚石>碳化硅>晶体硅
B.离子半径:S2->Cl->Na+>O2-
C.熔点:NaF>NaCl>NaBr>NaI
D.沸点:
 >
>
难度: 简单查看答案及解析
-
下列事实对应的化学用语表达错误的是
A.自然界中正常的雨水呈酸性:H2O+CO2
H2CO3 ,H2CO3
H++HCO3-
B.“NO2球”浸入冷水中颜色变浅:2NO2(g)(红棕色)
N2O4(g)(无色) ΔH<0
C.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+==S↓+SO2↑+H2O
D.甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
难度: 简单查看答案及解析
-
氧化锂(Li2O)是离子晶体,其晶格能可以通过图所示循环进行计算。下列说法错误的是

A.O=O键键能为ΔH3
B.Li原子的第一电离能为0.5ΔH2
C.Li2O的晶格能为ΔH6取正值
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH6=ΔH5
难度: 简单查看答案及解析
-
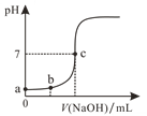
1909年,丹麦生理学家索仑生提出用pH表示水溶液的酸度:pH=-lg[H+],后来又定义pOH=-lg[OH-],pKW=-lgKW。对某水溶液的下列说法中错误的是
A.pH+pOH=pKW B.若为酸性溶液则pH>pOH
C.常温下pH+pOH=14 D.溶液pH=7时未必呈中性
难度: 简单查看答案及解析
-
在试管中进行下列实验,现象与实验操作不相匹配的是
实验操作
实验现象
A
向硫酸铜水溶液中逐滴加入氨水
先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液
B
向I2的CCl4溶液中加入浓KI溶液,振荡
溶液紫红色变浅
C
向橙色的K2Cr2O7溶液中加入10滴浓硫酸,振荡
溶液由橙色变为黄色
D
向饱和硼酸溶液中加入Na2CO3溶液
无明显现象
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是

A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中
保持不变
难度: 简单查看答案及解析
-
温度为T0时,X(g)和Y(g)在2 L的密闭容器中发生反应生成Z(g),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述中错误的是

A.反应的方程式为X(g)+Y(g)
2Z(g)
B.X(g)与Y(g)生成Z(g)的反应是放热反应
C.图a中反应达到平衡时,Y的转化率为62.5%
D.T1时,若该反应的平衡常数K的值为50,则T1>T0
难度: 简单查看答案及解析