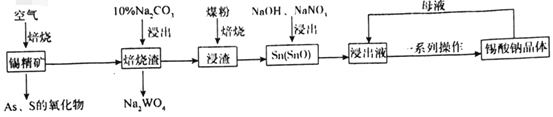
-
下列有关我国最新科技成果的说法不正确的是( )
A.北斗卫星的太阳能电池板可将太阳能直接转化为电能
B.国产飞机C919使用的燃油可从石油中分馏得到
C.高铁“复兴号”使用的碳纤维属于无机非金属材料
D.神威太湖之光超级计算机联网使用的光纤主要成分为晶体硅
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,2.24LCHCl3中含有的氯原子数目为0.3NA
B.23.5gAgI胶体中含胶粒的数目为0.1NA
C.2.4g单层石墨和6.2g白磷含有的共价键数目相同,均为0.3NA
D.常温下,pH=12的Na2CO3溶液中,由水电离出的OH-数目为10-2NA
难度: 中等查看答案及解析
-
已知:CH3CH(OH)CH2CH3
CH3CH=CHCH3+H2O,下列有关说法不正确的是( )
A.CH3CH=CHCH3分子中所有碳原子处于同一平面
B.与CH3CH=CHCH3和Cl2的加成产物分子式相同的物质共有8种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与甘油互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
实验室用浓硝酸氧化C2H2制取H2C2O4·2H2O的装置如图所示(电石主要成分为CaC2,含少量CaS杂质),下列说法正确的是( )
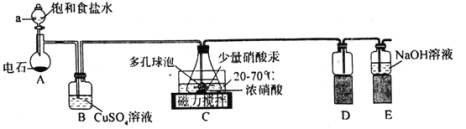
A.装置A可作MnO2和浓盐酸反应制备Cl2的发生装置
B.装置B的作用是除去C2H2中的H2S
C.装置D的作用是收集草酸
D.装置E中发生反应的离子方程式为3NO2+2OH-=2NO3-+NO+H2O
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Y的最外层电子数之比为4:3,X、Z同主族,Z的单质常温下为气体,下列说法正确的是( )
A.简单离子半径:Z>Y>X
B.氢化物的沸点:Z>W
C.元素的最高正价:W=Z>X>Y
D.W、Y分别与Z形成的二元化合物均为共价化合物
难度: 中等查看答案及解析
-
钾离子电池资源丰富,在非水基电解液中具有更高的离子导电率等优点。一种钾离子电池的工作原理如图所示,已知该电池负极在KC24-KC16-KC8之间变化,正极在K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6之间变化,下列说法不正确的是( )
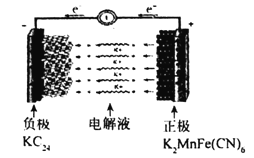
A.如图所示为钾离子电池的放电过程
B.放电时负极可发生反应:2KC8-e-=KC16+K+
C.充电时正极反应式为K2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.若充电前正负极质量相同,则充电时每转移0.lmole-,理论上正负极质量差将增加7.8g
难度: 困难查看答案及解析
-
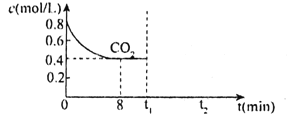
已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
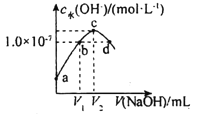
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
难度: 困难查看答案及解析