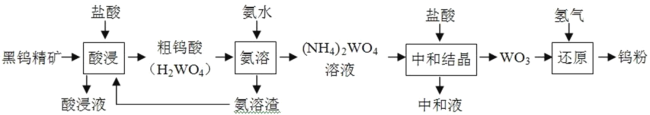
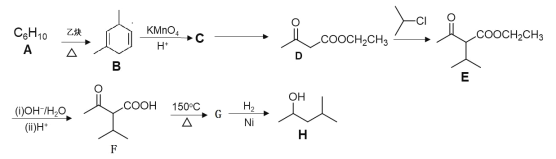
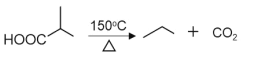
-
化学与生产、生活密切相关。下列说法错误的是
A.向豆浆中加入食用氯化钙使其凝固制豆腐的原理是胶体的聚沉
B.装修时用液态 CO2 作溶剂的油漆代替苯作溶剂的油漆,有利于环保
C.日常生活中常用合成材料涤纶是通过缩聚反应合成的
D.碳纤维、光导纤维、合成纤维均属于新型无机非金属材料
难度: 简单查看答案及解析
-
斑蝥黄是一种有机颜料,其结构如图所示,下列说法正确的是
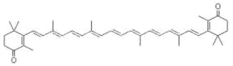
A.斑蝥黄的分子式为 C40H50O2
B.斑蝥黄的一氯代物可能存在 13 种结构(不考虑立体异构)
C.斑蝥黄能发生加成反应和酯化反应
D.斑蝥黄易溶于水和有机溶剂
难度: 简单查看答案及解析
-
科学家经过研究发现,CO2 与 H2 在催化剂作用下可转化成 CH3OH 燃料,是一种减排、环保的有效方法。该可 逆反应发生过程中的能量变化如图所示,下列说法错误的是
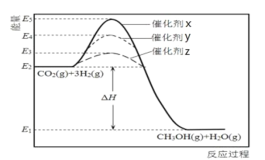
A.CH3OH(g)+H2O(g)
CO2(g)+3H2(g)为吸热反应
B.使用催化剂 x 时,正反应的活化能 = △H + 逆反应活化能
C.其他条件一定,与其他催化剂相比,使用催化剂 z 时,反应物 转化率可能更高
D.从图中可知,选用不同的催化剂,反应的△H也不同
难度: 中等查看答案及解析
-
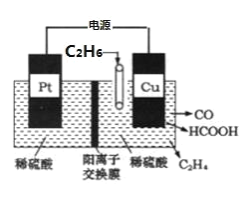
镁电池因具有高的安全性和低廉的价格而备受关注,我国科学 家最近研发出一种新型镁电池,其工作原理如图所示。下列说法正确的是
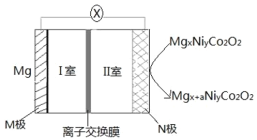
A.I 室中的电解质溶液可以是稀 H2SO4
B.外电路中转移 2mol 电子时,N 极质量增加 24a g
C.离子交换膜为阳离子交换膜
D.电子流向:M 电极→I 室→离子交换膜→II 室→N 极
难度: 简单查看答案及解析
-
X、Y、Z、W 是原子序数依次增大的短周期主族元素,X、Y 的最外层电子数均是其内层电子数的
,下列叙述正确的是
A.X 的单质着火时可用 CO2 扑灭
B.简单氢化物的稳定性:Y>Z>W
C.W 的氧化物对应的水化物均为强酸
D.YW3 和 Z2W2 中各原子最外层均满足 8 电子稳定结构
难度: 简单查看答案及解析
-
25℃时,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的绝热容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的体积 V与所得混合溶液温度 T的关系如图所示。 下列说法错误的是
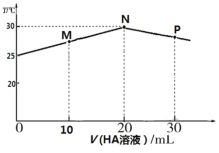
A.25℃时 pH=2 的 HA 溶液中 HA 的电离度约为 10%
B.M 点溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 点溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的过程中水的电离程度先增大后减小,M 点水电离程度小于 P 点
难度: 中等查看答案及解析
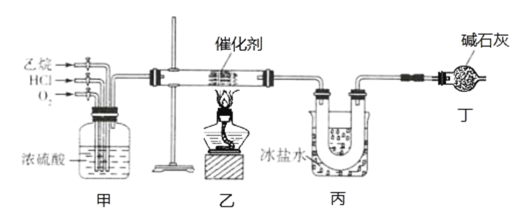
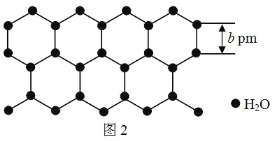
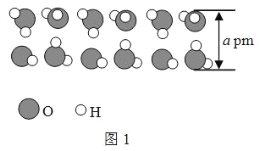
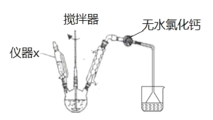
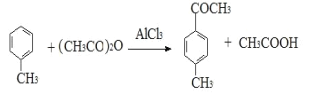 (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表: