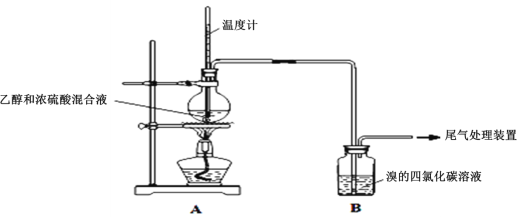
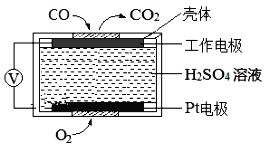
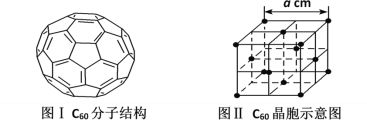
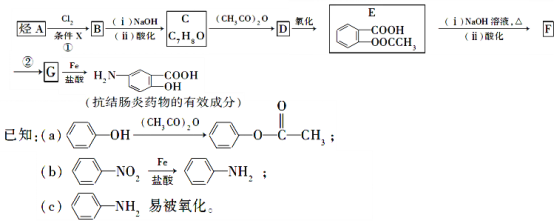
-
化学与社会、环境密切相关,下列有关说法正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.“梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的主要成分相同,都是合成纤维
C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D.对“地沟油”蒸馏可以获得汽油
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1molK2Cr2O7被还原为Cr3+转移的电子数为6NA
B.2.3gNa与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
C.3g3He含有的中子数为2NA
D.1mol乙烷和1mol乙烯中,化学键数相同
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.已知酸性的强弱顺序:H2CO3>HCN>HCO3-,则向NaCN溶液中通入少量的CO2时:2CN-+CO2+H2O=2HCN+CO32-
B.在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.侯氏制碱法:NaCl+NH3+CO2+H2O=NaHCO3+NH4+
D.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=ClO-+Cl-+H2O
难度: 中等查看答案及解析
-
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是( )
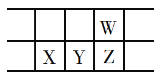
A.原子半径:W>Z
B.常温下,X的单质与Y的单质均能溶于浓硫酸
C.X的最高价氧化物的水化物是强碱
D.最简单气态氢化物热稳定性:Z<W
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
B.环己烯(
)分子中的所有碳原子共面
C.乙醇和丙三醇互为同系物
D.二环己烷(
)的一氯代物有3种结构(不考虑立体异构)
难度: 中等查看答案及解析
-
以下关于化学实验中“先与后”的说法中正确的是( )
①蒸馏时,先点燃酒精灯,再通冷凝水
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯
③实验室制取某气体时,先检查装置气密性后装药品
④分液时,先打开分液漏斗上口的塞子,后打开分液漏斗的旋塞
⑤H2还原CuO实验时,先检验气体纯度后点燃酒精灯
⑥使用托盘天平称盘物体质量时,先放质量较小的砝码,后放质量较大的砝码
⑦蒸馏时加热一段时间,发现忘记加沸石,应迅速补加沸石后继续加热
A.②③④⑤⑦ B.②③④⑤ C.①②③④⑦ D.全部
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.常温下将pH均为a的氢氧化钠溶液和氢氧化钡溶液分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(HA-)<c(A2-)
C.室温时,M(OH)2(s)
M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+
lg
D.Na2C2O4溶液:c(OH-)+2c(H2C2O4)=c(H+)+c(HC2O4-)
难度: 困难查看答案及解析