-
中国传统文化博大精深,明代方以智的《物理小识》中有关炼铁的记载:“煤则各处产之,臭者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石,殊为省力。”下列说法中正确的是
A.《物理小识》中记载的是以焦炭作为还原剂的方法来炼铁
B.文中说明以煤炭作为燃料被普遍使用,煤的主要成分为烃
C.生铁是指含硫、磷、碳量低的铁合金
D.工业上可通过煤的干馏获得乙烯、丙烯等化工原料
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.
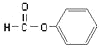 属于醛类,官能团为—CHO
属于醛类,官能团为—CHOB.分子式为C5H10O2的有机物中能与NaOH溶液反应的有4种
C.立方烷(
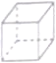 )的六氨基(-NH2)取代物有3种
)的六氨基(-NH2)取代物有3种D.烷烃
 的正确命名是2-甲基-3-丙基戊烷
的正确命名是2-甲基-3-丙基戊烷难度: 简单查看答案及解析
-
下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是( )
选项
实验器材
相应实验
A
试管、铁架台、导管
乙酸乙酯的制备
B
分液漏斗、烧杯、铁架台
用CCl4萃取溴水中的Br2
C
500mL容量瓶、烧杯、玻璃棒、天平
配制500 mL 1.00 mol/L NaCl
溶液
D
三脚架、坩埚、酒精灯、坩埚钳、泥三角
从食盐水中得到NaCl晶体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于物质结构与性质的说法,不正确的是( )
A.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
B.C、H、O三种元素的电负性由小到大的顺序为H<C<O
C.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
D.第四周期元素中,Ga的第一电离能低于Zn
难度: 简单查看答案及解析
-
新型冠状病毒肺炎疫情发生以来,科学和医学界积极寻找能够治疗病毒的药物。4-去甲基表鬼臼毒素具有抗肿瘤、抗菌、抗病毒等作用,分子结构如图所示,下列说法错误的是
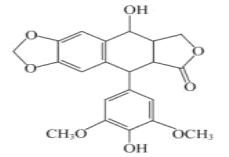
A.该有机物中有三种含氧官能团
B.该有机物有4个手性碳原子,且遇FeCl3溶液显紫色
C.该有机物分子中所有碳原子不可能共平面
D.1mol该有机物最多可以和2molNaOH、7molH2反应
难度: 简单查看答案及解析
-
有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
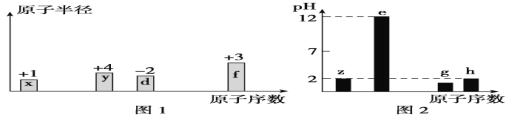
根据上述信息进行判断,下列说法正确是( )
A.d、e、f、g 形成的简单离子中,半径最大的是d离子
B.d与e形成的化合物中只存在离子键
C.x、y、z、d、e、f、g、h的单质中,f的熔点最高
D.x与y可以形成多种化合物,可能存在非极性共价键
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.水合铜离子的模型如图
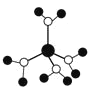 ,该微粒中存在极性共价键、配位键、离子键
,该微粒中存在极性共价键、配位键、离子键B.CaF2晶体的晶胞如图
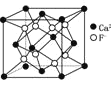 ,距离F-最近的Ca2+组成正四面体
,距离F-最近的Ca2+组成正四面体C.氢原子的电子云图如图
 ,氢原子核外大多数电子在原子核附近运动
,氢原子核外大多数电子在原子核附近运动D.金属Cu中Cu原子堆积模型如图
 ,为面心立方最密堆积,Cu原子的配位数均为12,晶胞空间利用率68%
,为面心立方最密堆积,Cu原子的配位数均为12,晶胞空间利用率68%难度: 简单查看答案及解析
-
重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是
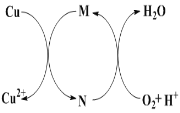
A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
难度: 简单查看答案及解析
-
乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
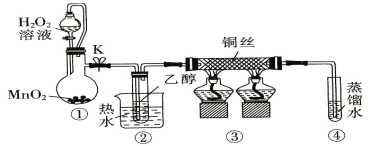
A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
难度: 中等查看答案及解析
-
碲被誉为“现代工业的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某科研小组从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲设计工艺流程如图所示。下列有关说法正确的是( )
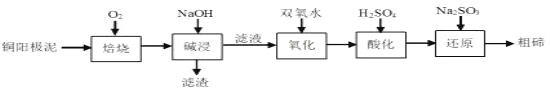
已知: ①“焙烧”后,碲主要以TeO2形式存在
②TeO2微溶于水,易溶于强酸和强碱
A.“焙烧”用到的主要硅酸盐产品仪器:蒸发皿、酒精灯、玻璃棒
B.“还原”时氧化剂与还原剂的物质的量之比为1:2
C.为加快“氧化”速率温度越高越好
D.TeO2是两性氧化物,碱浸时反应的离子方程式为TeO2 +2OH- =TeO32- +H2O
难度: 困难查看答案及解析
-
我国科学家设计的二氧化碳的熔盐捕获及电化学转化装置如图所示。下列说法正确的是( )
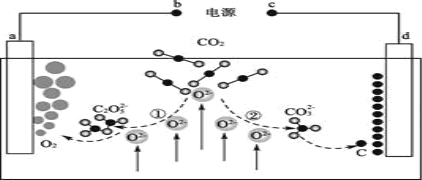
A.a极是电化学装置的阴极
B.d极的电极反应式为CO32- - 4e- = C + 3O2-
C.①中,捕获CO2时碳元素的化合价发生了变化
D.上述装置中反应的化学方程式为CO2
C + O2↑
难度: 中等查看答案及解析
-
室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a
通入0.01 mol HCl
加入0.01 mol NaOH
pH
4.76
4.67
4.85
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L−1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A−结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L−1 Na2HPO4 与0.1 mol·L−1 NaH2PO4的混合溶液也可做缓冲溶液
难度: 困难查看答案及解析
-
某研究小组以AgZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)
N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)
2CO2(g)+N2(g)]。下列说法正确的是 ( )
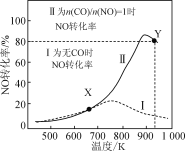
A.反应2NO
N2+O2的ΔH>0
B.达平衡后,其他条件不变,使n(CO)/n(NO)>1,CO转化率下降
C.X点可以通过更换高效催化剂提高NO转化率
D.Y点再通入CO、N2各0.01 mol,此时v(CO,正)<v(CO,逆)
难度: 中等查看答案及解析

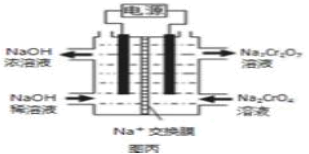
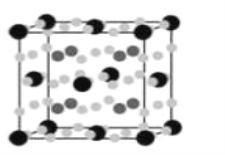
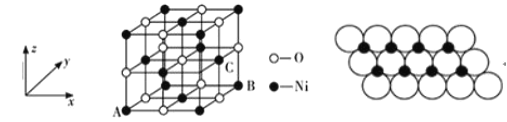
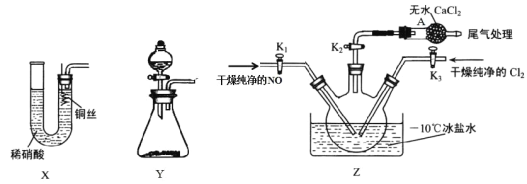



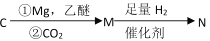 符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。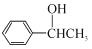 的路线流程图____________(其它试剂自选)。
的路线流程图____________(其它试剂自选)。