-
下列事实中不能证明CH3COOH是弱电解质的是( )
A.常温下某CH3COONa溶液的pH=8
B.常温下0.1mol·L-1CH3COOH溶液的pH=2.8
C.CH3COONa溶液与稀盐酸反应生成CH3COOH和NaCl
D.CH3COOH属于共价化合物
难度: 中等查看答案及解析
-
下列实验中,实验目的可以达到的是( )
选项
实验内容
实验目
A
滴定实验中,用待测液润洗锥形瓶2~3次
避免造成实验误差
B
向氯水滴加AgNO3、稀HNO3溶液,产生白色沉淀
验证氯水中含有Cl-
C
向盛有沸水的烧杯中滴加饱和氯化铁溶液并长时间煮沸
制备氢氧化铁胶体
D
向2mL 1mol· L-1NaOH溶液中先加入3滴1mol· L-1 MgCl2溶液,再加入3滴1mol· L-1 FeCl3溶液
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25 ℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20 mL浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是( )

A.HA为弱酸,BOH为强碱
B.a点时,溶液中粒子浓度存在关系:c(BOH)<c(B+)
C.b点时V=20
D.c、d两点溶液混合后微粒之间存在关系:c(H+)=c(OH-)+c(BOH)
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法不正确的是
A.向
溶液中通入
,
减小
B.将
的
溶液从
升温至
,
增大
C.向
的HF溶液中滴加NaOH溶液至中性,
=1
D.向
的
溶液中加入少量水,
增大
难度: 中等查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
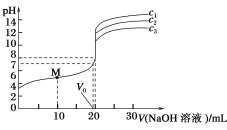
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=
(V0是消耗的NaOH溶液的体积)
难度: 困难查看答案及解析
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是( )
A.25 ℃时,0.01 mol·L-1 Na2S水溶液中,pC(H+)+pC(OH-)=14
B.用0.01 mol·L-1的NaOH溶液滴定某浓度的盐酸,滴定过程中pC(OH-)逐渐增大
C.某温度下,A2B难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B2-)=10
D.向0.01 mol·L-1的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pC(Ca2+)逐渐减小
难度: 困难查看答案及解析
-
25 ℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的NaHA和20.00 mL 0.100 mol·L-1 Na2A溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是( )
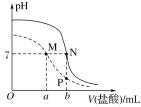
A.HA-的电离常数大于水解常数
B.b=2a
C.M、N点溶液均满足c(Na+)=2c(A2-)+c(HA-)
D.水的电离程度:M=N>P
难度: 困难查看答案及解析
-
常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
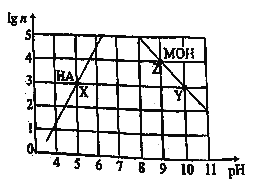
A.MOH为弱碱,HA为强酸
B.水的电离程度:X=Z>Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
难度: 困难查看答案及解析
-
向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=
]与混合液pH的关系如图所示。下列说法正确的是( )
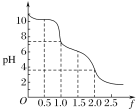
A.f=0时,溶液中:c(Na+)=2c(
)
B.f=0.5时,溶液中:c(
)>c(
)
C.f=1时,溶液中:c(Na+)+c(H+)=2c(
)+c(
)+c(OH-)
D.f=2时,溶液中:
c(Na+)=c(
)+c(
)+c(H2CO3)
难度: 困难查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
选项
X
Y
Z
R
A
Al
AlCl3
Al(OH)3
NaAlO2
B
Na
Na2O
Na2O2
NaOH
C
H2S
S
SO2
SO3
D
N2
NH3
NO
NO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
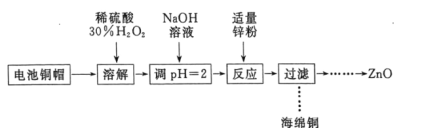
下列叙述错误的是( )
A.“溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C.与加入锌粉反应的离子为Cu2+、H+
D.“过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
难度: 中等查看答案及解析
-
以下实验原理或操作中,正确的是
A.用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高
B.仰视量筒刻度量取一定量浓硫酸所配制的
溶液的浓度结果偏低
C.焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色
D.要将溶解在
中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
难度: 中等查看答案及解析