-
25℃时,下列各组离子在指定溶液中可能大量共存的是( )
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. 无色溶液中:Cu2+、Al3+、NH4+、Cl-
C. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
A. 水、双氧水、水玻璃都是纯净物 B. 石墨和C60互称为同位素
C. 磷酸钙是可溶性强电解质 D. 一定条件下石墨转化为C60是化学变化
难度: 中等查看答案及解析
-
在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有5 mol H2O参加反应,被水还原的溴元素为( )
A.1 mol B.2/3 mol
C.4/3 mol D.2 mol
难度: 中等查看答案及解析
-
下列物质加工或应用中未利用其化学性质的是
选项
A
B
C
D
加工或应用




A.A B.B C.C D.D
难度: 中等查看答案及解析
-
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列各组物质分类中不合理的是( )
选项
分类标准
物质归类
A
FeSO4、NO2、MnO2、NaClO、Cu2O、Na2O2
H2SO3
B
CH3COOH、HOOC—COOH、HClO、H2S
HF
C
复分解反应、电解反应、放热反应、离子反应
焰色反应
D
(NH4)2SO4、NH4Cl、NH4NO3、(NH4)2CO3
NH4HCO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是
选项
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
KSCN溶液滴入FeCl3溶液中
CO2通过装有Na2O2固体的干燥管
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
溶液变为红色
固体由淡黄色变为白色
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关仪器使用方法或实验操作正确的是( )
A.洗净的容量瓶可以放进烘箱中烘干
B.配制溶液定容的操作图示:
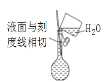
C.配制溶液时需要等液体冷却至室温再转移至容量瓶中。
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余的液体
难度: 简单查看答案及解析
-
下列有关叙述正确的是( )
A.Na2O·SiO2是一种简单的硅酸盐,可溶于水
B.Na2O2与Na2O一样都属于碱性氧化物
C.稀硫酸、NaCl溶液是实验室常见的电解质
D.酸性氧化物均能与水反应生成对应的酸
难度: 中等查看答案及解析
-
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面。高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,在198℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.常温常压下,19gH3O+含有10NA个电子
B.4.0gH218O与D2O的混合物中所含中子数为2NA
C.标准状况下,22.4LCH4和C2H4的混合气体所含氢原子数为4NA
D.含3.0gHCHO的水溶液中原子总数为0.4NA
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A.明矾做净水剂:Al3+ + 3H2O = Al (OH)3↓+ 3H+
B.小苏打治疗胃酸过多:CO32-+ 2H+ = CO2↑+ H2O
C.漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D.酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I- + O2 +2H2O= 2I2 + 4OH-
难度: 简单查看答案及解析
-
我国科学家首次将一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”的分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子所形成的分散系较稳定
C.“钴酞菁”分子既能透过滤纸,也能透过半透膜
D.此项研究可广泛用于光电器件、生物技术等方面
难度: 中等查看答案及解析
-
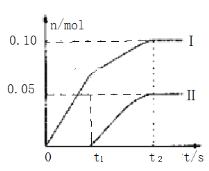
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
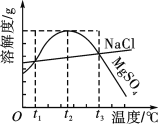
A.只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C.在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.3.36LNO2与水充分反应转移的电子数目为0.1NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.与常温常压下17gH2O2所含非极性键数目相同的N2H4的分子总数为0.5NA
D.50mL12mol·L-1盐酸与足量MnO2共热,转移电子数为0.3NA
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知
类推
A
将Fe加入CuSO4溶液中:
Fe + Cu2+ = Cu + Fe2+
将Na加入到CuSO4溶液中:
2Na + Cu2+ = Cu + 2Na+
B
稀硫酸与Ba(OH)2溶液反应至溶液呈中性:
2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
NaHSO4溶液与Ba(OH)2溶液反应呈中性:
2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O
C
铁和氯气反应2Fe+3Cl2
2FeCl3
铁和单质反应2Fe+3I2
2FeI3
D
向Ca(ClO)2溶液中通入少量CO2:
Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:
Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
A.NO2 B.NO C.N2O D.NH4NO3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
B.将0.2molFeCl3水解制成胶体,所得胶体粒子数为0.2NA
C.0.1molNa2O2中所含的阴离子数为0.2NA
D.1mol熔融的KHSO4中含有NA个阳离子
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在3种离子
B.Cl-一定存在,且c(Cl‑)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
难度: 中等查看答案及解析
-
某溶液中含有VO2+和Cr2O72-,现向此溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+→VO2+,Cr2O72-→Cr3+。再滴入2.00mL,0.020mol/LKMnO4溶液,又恰好使VO2+→VO2+,而Cr3+不变,此时MnO4→Mn2+,则原溶液中Cr的质量为( )
A.15.6mg B.23.4mg C.31.2mg D.46.8mg
难度: 中等查看答案及解析