-
为纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。通常,我们将元素周期表的创造归功于
A.阿佛加德罗 B.盖斯 C.勒夏特列 D.门捷列夫
难度: 简单查看答案及解析
-
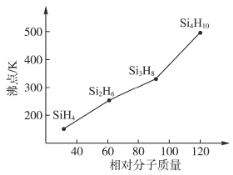
下列化学式既能表示物质的组成,又能表示物质分子式的是
A.Na B.SiO2 C.H2O D.CuSO4·5H2O
难度: 简单查看答案及解析
-
生活中的下列现象与原子核外电子发生跃迁有关的是( )
A.钢铁长期使用后生锈
B.节日里燃放的焰火
C.金属导线可以导电
D.乙醇发出特殊的香味
难度: 简单查看答案及解析
-
下列变化需克服相同类型作用力的是
A.液溴和汞的气化 B.氯化钠和氯化氢的溶解
C.碘和干冰的升华 D.C60和石英的熔化
难度: 简单查看答案及解析
-
按原子核外电子排布,可把周期表里的元素划分成5个区,以下元素属于d区的是.
A.As B.Mg C.Zn D.Fe
难度: 简单查看答案及解析
-
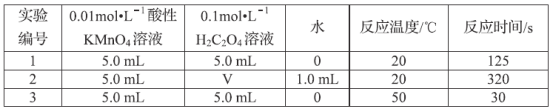
做中和热测定实验时,所用仪器的正确组合是
①容量瓶 ②量筒 ③酒精灯 ④天平 ⑤环形玻璃搅拌棒 ⑥试管 ⑦烧杯 ⑧温度计
A.②⑤⑦⑧ B.②③④⑦ C.①②⑤⑦⑧ D.全部
难度: 简单查看答案及解析
-
有关氢键的下列说法正确的是:
A.氢键比范德华力强,是氢元素与其它元素形成的一种特殊的化学键
B.氢键是乙醇熔沸点比乙烷高的原因之一
C.只有分子之间才可能形成氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 简单查看答案及解析
-
下列有关杂化轨道的说法正确的是
A.轨道杂化前后数目相等,形状、能量不同
B.杂化轨道既可形成σ键,也可形成π键
C.金刚石和石墨晶体中的C原子都是通过sp3杂化轨道成键
D.分子中中心原子通过sp3杂化轨道成键时该分子不一定为正四面体结构,所以杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
难度: 中等查看答案及解析
-
以离子键为主的化学键中常含有共价键的成分,两种元素电负性差异越小,其共价键成分越大。下列各对原子形成的化学键中共价键成分最多的是
A.K与F B.Na与O C.Al与Cl D.Ca与Cl
难度: 中等查看答案及解析
-
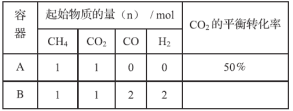
下列叙述中能肯定判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变 B.混合体系中气体密度发生变化
C.正、逆反应速率改变 D.反应物的转化率改变
难度: 中等查看答案及解析
-
下列有关化合物的叙述中正确的是
A.在共价化合物分子中一定同时存在σ键和π键
B.离子化合物的熔点一定比共价化合物的高
C.全由非金属元素组成的化合物一定是共价化合物
D.含有阳离子的化合物一定含有阴离子
难度: 简单查看答案及解析
-
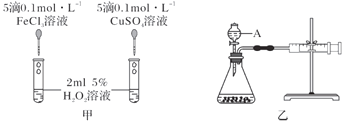
下列对一些实验事实的理论解释正确的是

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关化学反应方向的描述中正确的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.知道了某过程有自发性之后,可预测反应过程发生的快慢
C.CaCO3(s)
CaO(s)+CO2(g) △H>0,该反应能否自发进行与温度无关
D.冰融化为水的过程中:△H<0,△S>0
难度: 中等查看答案及解析
-
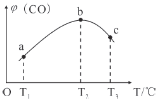
已知某可逆反应mA(g)+nB(g)
pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 P1>P2 m+n>p放热反应 B.T1>T2 P1<P2 m+n>p吸热反应
C.T1<T2 P1>P2 m+n<p放热反应 D.T1>T2 P1<P2 m+n<p吸热反应
难度: 中等查看答案及解析
-
以下各分子中,所有原子都满足最外层为8电子结构的是
A.NO2 B.BF3 C.PCl3 D.SF6
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.已知甲烷的燃烧热为890.3 kJ· mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ· mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.已知S(g)+O2(g)=SO2(g) △H1:S(s)+O2(g)=SO2(g) △H2,则△H1<△H2
D.已知中和热为△H=-57.3 kJ· mol-1,则1 mol稀硫酸和足量稀Ba(OH)2溶液反应放出的热量为2×57.3kJ
难度: 中等查看答案及解析
-
已知:2NO(g)+O2(g)
2NO2(g) △H1 K1
2NO2(g)
N2O4(g) △H2 K2
2NO(g)+O2(g)
N2O4(g) △H3 K3
则下列关系式正确的是
A.K1×K2=K3 △H1×△H2=△H3
B.K1×K2=K3 △H1+△H2=△H3
C.K1+K2=K3 △H1×△H2=△H3
D.K1+K2=K3 △H1+△H2=△H3
难度: 中等查看答案及解析
-
国际计量大会第26届会议新修订了阿伏加德罗常数的值(NA=6.02214076×1023 mol-1),并于2019年5月20日正式生效,下列叙述正确的是
A.32 g S8(分子结构:
)中的共价键数目为NA
B.含16 g氧原子的二氧化硅晶体中含有的σ键数目为NA
C.1.2 g金刚石与石墨的混合物中含有碳碳单键的数目为0.4NA
D.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA
难度: 中等查看答案及解析
-
已知反应式:aA(g)+bB(?)
cC(s)+2aD(g)。当反应达平衡时,c(A)=0.5 mol/L,其他条件不变,若将容器体积缩小到原来的一半,测得c(A)=0.9 mol/L,下列说法错误的是
A.b>a B.D的体积分数增大
C.反应向逆反应方向移动 D.B的状态一定是气体
难度: 中等查看答案及解析
-
CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
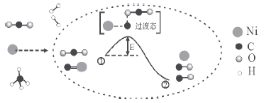
下列说法不正确的是
A.合成气的主要成分为CO和H2 B.①→②既有碳氧键的断裂,又有碳氧键的形成
C.Ni在该反应中做催化剂 D.①→②吸收能量
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W、X、Y最外层电子数之和为11,且化合物X2W2常作供氧剂,Y的原子序数是Z的最外层电子数的2倍。下列叙述正确的是
A.气态氢化物稳定性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.在XZ晶体中,阴阳离子的配位数均为8
难度: 中等查看答案及解析
-
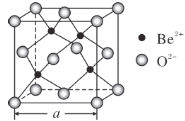
图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中Q为+3价,G为-2价,则R的化合价为
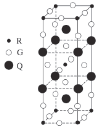
A.+1 B.+2 C.+3 D.+4
难度: 中等查看答案及解析