-
化学与生活密切相关。下列说法中不正确的是( )
A.漂白粉的有效成分为Ca(ClO)2
B.碳酸氢钠可用于治疗胃酸过多
C.酸中毒病人可输入0.9%的氯化铵溶液
D.工业上可利用油脂的碱性水解制取肥皂
难度: 简单查看答案及解析
-
下列关于化学用语表示正确的是( )
A.F-的结构示意图:
B.中子数是19的Cl原子:
Cl
C.二氧化碳分子的比例模型:
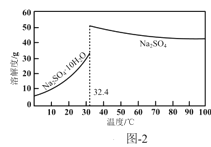
D.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.Al2O3熔点很高,可用于制造耐火材料
B.SiO2硬度很大,可用于制作光导纤维
C.FeCl3溶液显酸性,可用于制作印刷电路板
D.SO2具有还原性,可用于漂白纸浆
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1的KMnO4溶液:Na+、Cl-、SO32-
B.使紫色石蕊试液显蓝色的溶液:K+、AlO2-、NO3-
C.0.1mol·L-1FeCl3溶液:NH4+、SCN-、SO42-
D.
=1×1012的溶液:Na+、SO42-、HCO3-
难度: 简单查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.N2在O2中燃烧生成NO
B.SO3与H2O反应生成H2SO3
C.常温下,Fe在浓盐酸中发生钝化
D.AlCl3稀溶液和过量稀氨水反应生成Al(OH)3
难度: 简单查看答案及解析
-
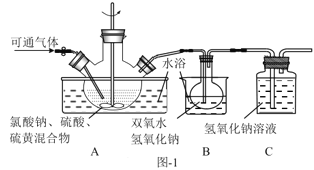
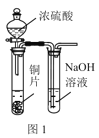
下列实验操作能达到实验目的的是( )
A.用图1所示装置验证浓硫酸具有强氧化性
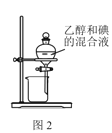
B.用图2所示装置分离乙醇和碘的混合液
C.向FeSO4溶液中加铁粉,防止其被氧化
D.用KMnO4溶液除去乙烯中的少量SO2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向氨水中通入过量CO2:2NH3·H2O+CO2=2NH4++CO32-+H2O
B.Zn与稀醋酸反应:Zn+2H+=Zn2++H2↑
C.用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
D.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3=2FeO42-+3Cl-+5H2O
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是( )
A.B2A2中阴阳离子的个数比为1:1
B.原子半径的大小顺序:r(D)>r(C)>r(B)>r(A)
C.A的简单气态氢化物的热稳定性比D的弱
D.B、C的最高价氧化物的水化物之间能发生反应
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CuO(s)
Cu(s)
CuCl2(aq)
B.Na(s)
Na2O(s)
NaOH(aq)
C.NH3(g)
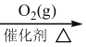 NO(g)
NO(g)HNO3(aq)
D.HCl(aq)
Cl2(g)
NaClO(aq)
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符合的是( )
A.图甲表示向CH3COOH溶液中逐渐加入少量CH3COONa固体后,溶液pH的变化
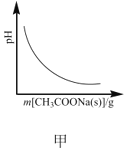
B.图乙表示用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1醋酸溶液的滴定曲线
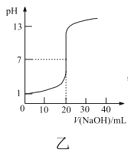
C.图丙表示电解法处理污水的原理,生成的胶体能除去污水中的悬浮物,该装置中的铁片可用铝片代替
D.图丁表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
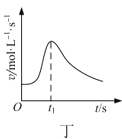
难度: 中等查看答案及解析
-
甲醇-空气燃料电池的反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列有关说法正确的是( )
A.甲醇-空气燃料电池的负极反应为CH3OH-6e-+8OH-=CO32-+6H2O
B.一定温度下,反应2H2(g)+CO(g)=CH3OH(g)能自发进行,该反应的ΔH>0
C.根据共价键的键能可以准确计算CO2(g)+3H2(g)=CH3OH(g)+H2O(l)的ΔH
D.标准状况下,甲醇-空气燃料电池放电时消耗5.6LO2,转移电子的数目约为3.01×1023
难度: 中等查看答案及解析
-
化合物Y在医药上具有广泛用途,可由X制得。下列有关化合物X、Y的说法正确的是( )
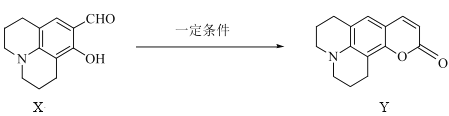
A.X分子中所有原子可能在同一平面上
B.1molY最多能与1molNaOH反应
C.X、Y均能与酸性KMnO4溶液反应
D.X、Y分别与足量H2加成的产物分子中手性碳原子数目不相等
难度: 简单查看答案及解析
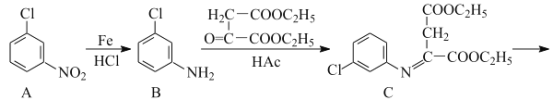
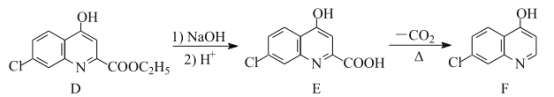
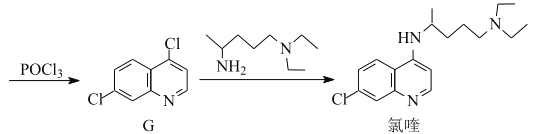
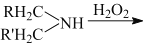 RHC=N-CH2R’
RHC=N-CH2R’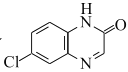 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
 ×100%
×100%