-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热 △H = 2×(-57.3) kJ/mol
B.CO(g)的燃烧热283.0 kJ/mol,则反应 2CO(g)+O2 (g)=2CO2(g)的△H= -2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 简单查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)=K2S(s) +N2(g) +3CO2 (g) △H = xkJ•mol-1。已知:
①碳的燃烧热△H1 =a kJ • mol-1 ;
②S(s)+2K(s) =K2S(s) △H2=b kJ•mol-1 ;
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H 3=ckJ•mol-1。
则x为
A.a+b-c B.c+3a-b C.3a + b-c D.c + a- b
难度: 简单查看答案及解析
-
一定温度下,反应 N2(g)+O2(g)
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A. 缩小体积使压强增大 B. 升高体系的温度
C. 恒容,充入He D. 加入合适的催化剂
难度: 简单查看答案及解析
-
5.6g铁粉投入到盛有100mL 2mol•L-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
A. v(H2SO4)=0.5mol• (L•min)-1 B. v(H2SO4)=1 mol• (L•min)-1
C. v(Fe)=0.5mol• (L•min)-1 D. v(FeSO4)=1mol• (L•min)-1
难度: 简单查看答案及解析
-
已知:3H2(g)+N2(g)⇌2NH3(g)△H=-92kJ/mol,在催化剂存在时反应过程中的能量变化如图所示。下列叙述正确的是
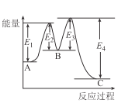
A.△H=E2-E1+E3-E4
B.加入催化剂后反应经过两步完成,其中第一步反应决定总反应速率
C.加入催化剂,△H、反应速率均发生改变
D.向密闭容器中充入3 mol H2和1molN2,发生上述反应,达到平衡时,反应放出92 kJ热量
难度: 中等查看答案及解析
-
用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,待测液放在锥形瓶中。中和滴定时下列操作会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.碱式滴定管未用待测碱液润洗
B.酸式滴定管未用标准盐酸润洗
C.滴定过程中滴定管内不慎有标准液溅出
D.滴定前俯视读数,滴定后读数正确
难度: 简单查看答案及解析
-
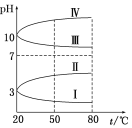
已知:某温度下,铁的难溶化合物FeS在溶液中存在溶解平衡FeS(s)⇌Fe2+ (aq) + S2-(aq),FeS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
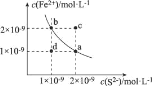
A.a点对应的Ksp(FeS)等于b点对应的Ksp(FeS)
B.c、d两点有沉淀析出的是c点
C.向d点溶液中加入FeCl3溶液,溶液中的离子浓度可实现由d点到b点的变化
D.该温度下,Ksp (FeS) =2×10-18
难度: 困难查看答案及解析
-
已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
难度: 简单查看答案及解析
-
下列根据实验操作和现象得出的结论正确的是
选项
实验操作和现象
结论
A
相同条件下,分别测量0.01mol/L和0.001mol/L草酸溶液的导电性,前者的导电性强
草酸浓度越大,电离程度越大
B
室温下,向浓度均为0.1mol/L的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀
室温下,Ksp(AgI)> Ksp(AgCl)
C
取5mL0.1mol/LKI溶液,加入1mL0.1mol/LFeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色
Fe3+与I-发生的反应为可逆反应
D
已知KAlO2溶液的pH>7,将其蒸干并灼烧,得到固体残留物
该固体为Al2O3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
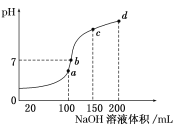
室温下,分别取10 mL pH均为2的盐酸、醋酸溶液分别与10mL 0.01 mol• L-1 NaHCO3溶液混合,实验测得产生CO2气体的体积(V)随时间(t)的变化如图所示。下列说法不正确的是
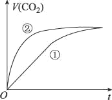
A.①表示的是盐酸的反应曲线
B.混合后的溶液中:c(CH3COO-)>c(C1-)
C.上述混合前三种溶液中水的电离程度:NaHCO3溶液>醋酸溶液=盐酸
D.醋酸和NaHCO3溶液混合后,所得的溶液中:c(CH3COO-)+ c(CH3COOH) = 0.005 mol• L-1
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示。下列说法正确的是

A.温度:a>b>c
B.仅升高温度,可从a点变为c点
C.水的离子积常数Kw:b>c>d
D.b点对应温度下,0.5 mol/L H2SO4溶液与1mol/L KOH溶液等体积混合,充分反应后,所得溶液中c(H+) = 1.0×10-7 mol • L-1
难度: 中等查看答案及解析
-
下列表述与示意图一致的是

A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04mol•L-1•min-1
难度: 困难查看答案及解析
-
向温度为300℃的2 L密闭容器中充入2 mol SO2和1 mol O2,发生反应2SO2 (g)+ O2 (g)
2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
A.该温度下,反应的平衡常数K =1620
B.SO2和O2的平衡转化率相等
C.平衡后保持温度和容器体积不变,再充入SO3(g),平衡常数不变
D.若不再向容器中加入任何物质,仅改变条件不可能使SO2的浓度达到1 mol/L
难度: 困难查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对X2 (g)+3Y2 (g)=2XY3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是
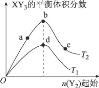
A.若T2>T1,则正反应一定是放热反应
B.T2和n (X2)不变,达到平衡时,XY3的物质的量:c>b>a
C.T2和n(X2)不变,达到平衡时,X2的转化率:b>a>c
D.若T2>T1,达到平衡时b、d点的正反应速率:v(d)>v (b)
难度: 困难查看答案及解析
-
25 ℃时,浓度均为1 mol•L-1的四种正盐溶液AX、BX、AY、BY;AX溶液的pH = 7且溶液中c(X-) = 1 mol•L-1 ,BX溶液的pH =4,BY溶液的pH =6。下列说法正确的是
A.电离常数:K(BOH)<K(HY)
B.AY溶液的pH小于BY溶液的pH
C.稀释相同倍数,BX溶液的pH变化等于BY溶液的pH变化
D.将浓度均为1mol•L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY 溶液的pH
难度: 中等查看答案及解析
-
已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器
甲
乙
丙
反应物投入量
1mol O2、2mol SO2
2mol SO3
1mol SO3
SO3的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
反应物转化率
α1
α2
α3
下列说法不正确的是
A.c1>2c3 B.a+b=196.6
C.p2>2p3 D.α1+α3>1
难度: 中等查看答案及解析