-
下列电池能实现化学能与电能相互转化的是
A.
 锌锰干电池 B.
锌锰干电池 B. 可充电锂电池
可充电锂电池C.
 氢燃料电池 D.
氢燃料电池 D. 锌银纽扣电池
锌银纽扣电池难度: 简单查看答案及解析
-
下列物质中,属于弱电解质的是
A.氨水 B.二氧化硫 C.冰醋酸 D.甲烷
难度: 简单查看答案及解析
-
某温度下容积固定的密闭容器中进行反应2SO2(g)+O2(g)⇌2SO3(g),下列各选项中,不能表明反应已达平衡的是
A.容器中气体物质的量不随时间而变化 B.反应物的转化率不随时间而变化
C.2v(O2)正=v(SO3)逆 D.容器中气体的密度不随时间而变化
难度: 简单查看答案及解析
-
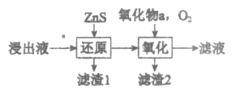
将TiO2转化为TiCl4是工业冶炼金属Ti的主要反应之一。已知:
TiO2(s)+2Cl2(g)=TiCl4(1)+O2(g) ∆H=+140.5kJ/mol
2CO(g)=2C(s,石墨)+O2(g) ∆H=+221.0 kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(1)+2CO(g)的∆H为
A.-30.0kJ/mol B.+30.0 kJ/mol C.-80.5kJ/mol D.+80.5kJ/mol
难度: 简单查看答案及解析
-
对化学反应2A(g)+B(g)=3C(g)+4D(g),下列选项中表示该反应速率最快的是
A.v(A)=0.6 mol/(L·s) B.v(B)=0.2 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1.0 mol/(L·s)
难度: 简单查看答案及解析
-
在容积为5L的密闭容器中注入2molA气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g)⇌2C(g),达平衡后,在相同温度下测得容器内混合气体的压强是反应前的5/6,则B气体的平衡转化率为
A.5% B.25% C.50% D.67%
难度: 简单查看答案及解析
-
常温下,下列事实能说明HClO是弱电解质的是
A.HClO在光照条件下易分解成HCl和O2
B.0.01mol/L NaClO溶液的pH>7
C.NaClO的电离方程式:NaClO=Na++ClO-
D.HClO与Na2SO3溶液反应,可以得到Na2SO4
难度: 简单查看答案及解析
-
常温下,将pH=3的盐酸与pH=11的某碱溶液等体积混和后,所得溶液的pH值
A.<7 B.=7 C.
7 D.
7
难度: 简单查看答案及解析
-
常温下用0.1mol/LNaOH溶液滴定20mL 0.1mol/L盐酸,恰好中和后不慎多加了1滴NaOH溶液(1滴溶液的体积以0.05mL计),再往锥形瓶中加蒸馏水至反应液的总体积为50mL,此时混合溶液的pH约为
A.4 B.7.2 C.10 D.11.3
难度: 简单查看答案及解析
-
对滴有酚酞试液的Na2CO3溶液,下列操作后红色会加深的是
A.降温 B.通入CO2气体
C.加入少量CaCl2固体 D.加入少量NaOH固体
难度: 简单查看答案及解析
-
某pH=1的无色透明溶液中能大量共存的离子组是
A.Na+、NO3-、HCO3-、Cl- B.Al3+、SO42-、NH4+、Cl-
C.Fe2+、K+、SO42-、NO3- D.Cl-、Na+、S2O32-、K+
难度: 简单查看答案及解析
-
将下列物质的水溶液在蒸发皿中蒸干后充分灼烧,最终能得到该溶质固体的是
A.FeCl3 B.K2CO3 C.Na2SO3 D.NaHCO3
难度: 简单查看答案及解析
-
关于下列装置的说法正确的是

A.装置①中Cu为正极,电极上大量气泡产生
B.装置①中e-的迁移方向是:Zn→导线→Cu→盐桥→Zn
C.若装置②用于铁棒镀铜,则N极为铜棒
D.若装置②用于电解精炼铜,则电解前后溶液中的Cu2+浓度保持不变
难度: 简单查看答案及解析
-
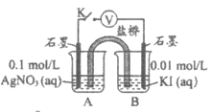
用惰性电极电解浓度均为0.1mol/L的下列溶液。电解一段时间后停止通电并搅拌混匀,电解前后溶液pH保持不变的是
A.KCl溶液 B.NaHSO4溶液 C.AgNO3溶液 D.Na2SO4溶液
难度: 简单查看答案及解析
-
模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
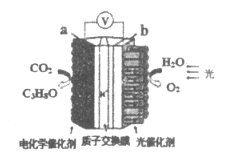
A.该装置将化学能转化为光能和电能
B.b电极上发生得e-的氧化反应
C.该装置工作时,H+从b极区向a极区迁移
D.a电极上反应:3CO2+18H+-18e-=C3H8O+5H2O
难度: 简单查看答案及解析
-
下列事实不能用电化学原理解释的是
A.常温下,在空气中铝不容易被腐蚀
B.在远洋海轮的船体吃水线以下焊上一定数量的锌板
C.为了保护地下钢管不受腐蚀,可将钢管与直流电源的负极相连
D.用锌粒与稀H2SO4制H2时,往溶液中加几滴CuSO4溶液以加快反应速率
难度: 简单查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是
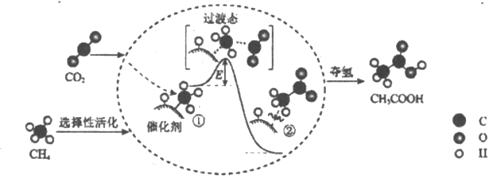
A.转化过程中发生了氧化还原反应
B.①→②放出能量并形成了C—C键
C.生成CH3COOH总反应的原子利用率为100%
D.该催化剂降低了反应活化能,反应物平衡转化率得到提高
难度: 简单查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)⇌I3-(aq)。在某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
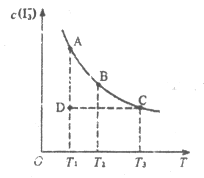
A.向混合溶液中加水,平衡逆向移动
B.反应I2(aq)+I-(aq)⇌I3-(aq)的∆H<0
C.状态A与状态B相比,I2的消耗速率A<B
D.状态C与状态D相比,反应的平衡常数KC=KD
难度: 中等查看答案及解析
-
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B
C
D
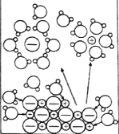
NaCl溶于水
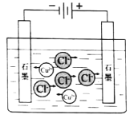
电解CuCl2溶液

CH3COOH在水中电离
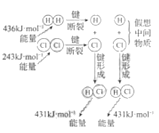 H2与Cl2反应能量变化
H2与Cl2反应能量变化NaCl
Na++Cl−
CuCl2
Cu2++2Cl−
CH3COOH
CH3COO−+H+
H2(g)+Cl2(g)
2HCl(g)
ΔH=−183kJ·mol−1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向1L pH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(
)的关系如图所示。下列叙述正确的是
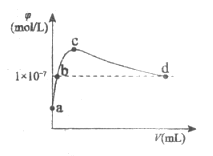
A.a点溶液:水电离的c(OH-)=1×10-4mol/L
B.b点溶液:c(OH-)=c(H+)
C.c点溶液:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.d点溶液:c(Na+)>2c(CO32-)+c(HCO3-)
难度: 中等查看答案及解析
-
下列实验不能达到实验目的的是
A.
 研究浓度对反应速率的影响
研究浓度对反应速率的影响B.
 研究阳离子对H2O2分解速率的影响
研究阳离子对H2O2分解速率的影响C.
 研究沉淀的转化
研究沉淀的转化D.
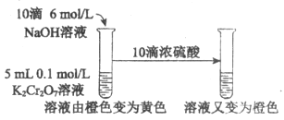 研究酸碱性对平衡移动的影响
研究酸碱性对平衡移动的影响难度: 简单查看答案及解析
-
碘化亚铜(CuI)是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而制得。选取铜片、石墨、KI溶液组成电化学装置制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法不正确的是
A.铜片做阳极,石墨做阴极
B.白色沉淀在靠近阳极处产生
C.阴极区溶液变红的原因:2H++2e-=H2↑,促进H2O电离,c(OH-)升高
D.阳极区溶液变蓝的原因:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,I2遇淀粉变蓝
难度: 中等查看答案及解析
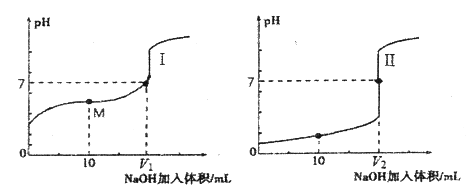
 0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.