-
下列有关化学与生活的说法错误的是( )
A.用可溶性的铝盐和铁盐对水进行杀菌消毒
B.用石灰、碳酸钠等碱性物质处理废水中的酸
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
难度: 中等查看答案及解析
-
香茅醛Y主要用于食用香精,也用作其他香料的原料,在一定条件下可分别转化为X、Z。下列叙述错误的是( )
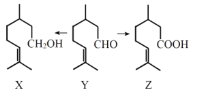
A.Y的分子式为C10H18O
B.X能与Z发生取代反应
C.可用新制Cu(OH)2鉴别出X、Y、Z
D.X、Y、Z均存在对应的芳香族同分异构体
难度: 中等查看答案及解析
-
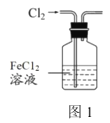
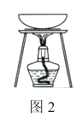
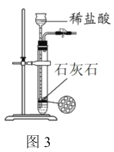
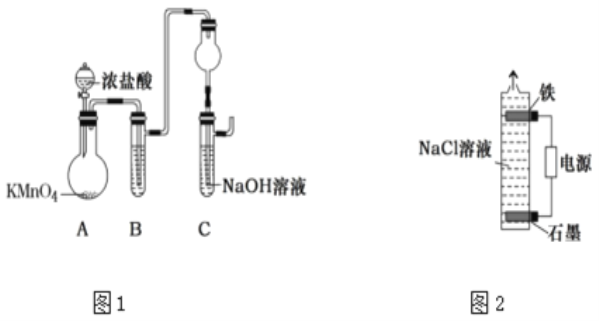
下列实验装置进行的相应实验,不能达到实验目的的是( )
A.图1装置:吸收少量C12
B.图2装置:从KI和I2的固体混合物中回收I2
C.图3装置:制取少量CO2气体
D.图4装置:分离CCl4萃取碘水后的有机层和水层
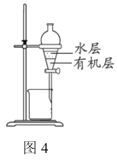
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z和W的原子序数依次增大,X、Y、W位于不同周期,Y、Z、W的原子最外层电子数之和为14,Z的原子半径在短周期主族元素中最大。下列说法错误的是( )
A.简单离子半径:W>Z>X
B.W的最高价氧化物对应的水化物为强酸
C.Y与Z形成的化合物溶于水所得溶液呈碱性
D.与X形成的简单化合物的还原性:Y>Z>W
难度: 困难查看答案及解析
-
研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )
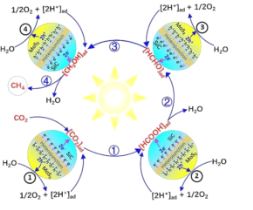
A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)
CH4(g)+2O2(g)
难度: 困难查看答案及解析
-
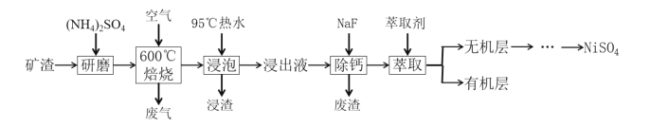
储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
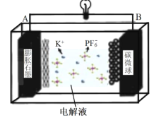
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
难度: 困难查看答案及解析
-
常温下,向20mL0.1mol•L-1NH4HSO4溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
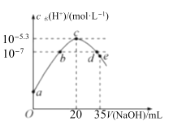
A.c点之前,主要的反应为NH4++OH-═NH3•H2O
B.b点和d点对应溶液的pH均为7
C.常温下,Kb(NH3•H2O)=5×10-5.4mol•L-1
D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-)
难度: 困难查看答案及解析
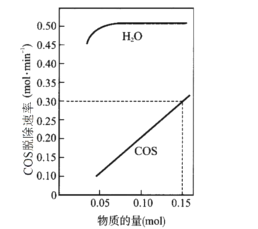
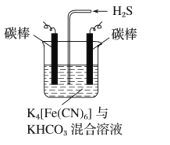
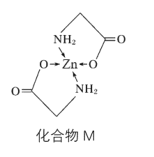
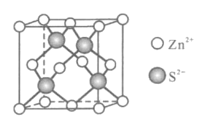
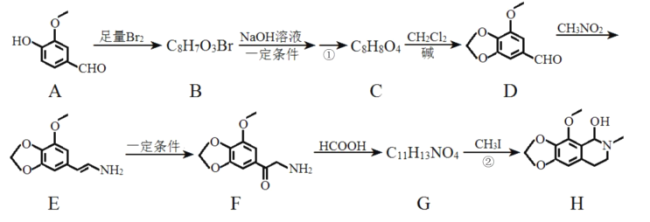
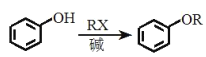 ;
;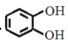 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物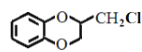 ,写出制备的合成路线流程图(无机试剂任选)__。
,写出制备的合成路线流程图(无机试剂任选)__。