-
化学与生活密切相关,下列说法正确的是( )
A.pH小于7的雨水是酸雨
B.氨可用作制冷剂
C.PM2.5中含有铅、铬、钒、砷等对人体有害的元素均是金属元素
D.含有氟化钠等氟化合物的牙膏有害健康,应禁止使用
难度: 简单查看答案及解析
-
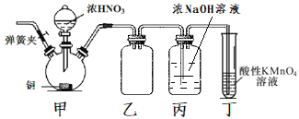
对图示“石蜡油(液态烷烃混合物)催化分解”的实验说法不正确的是( )
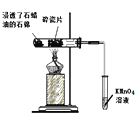
A.碎瓷片对石蜡油的分解起到催化作用
B.酸性高锰酸钾溶液褪色
C.石蜡油分解产生的不饱和烃一定是乙烯
D.若试管中盛放溴的四氯化碳溶液,发生的是加成反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.30gC2H6含共价键的数目为7NA
B.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
C.0.1mol/L氨水中含有OH-的数目为0.1NA
D.一定条件下,0.1molN2与足量H2反应生成NH3,转移电子数为0.6NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大。已知W、Y同一主族,W、X、Y三种元素原子的最外层电子数之和为15,X元素原子的最外层电子数等于W元素原子的最外层电子数的一半,下列叙述正确的是( )
A.离子半径:X>Y>Z>W
B.Y的气态氢化物稳定性强于Z的气态氢化物稳定性
C.Z的最高价含氧酸酸性强于Y的最高价含氧酸酸性
D.Y与W两种元素形成的化合物只有一种
难度: 中等查看答案及解析
-
下表所列实验中,“解释”正确的是( )
选项
目的
选用试剂或条件
解释
A
鉴别乙醇和苯
水
利用密度不同
B
除去SO42-中混有的SO32-
H2O2
H2O2具有氧化性
C
从碘水中提取碘
CCl4
因为CCl4密度比水大
D
分离碳酸钠和氯化铵混合物
加热
利用熔点不同
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
镁—锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。工作原理如图所示,下列有关该二次电池说法正确的是( )
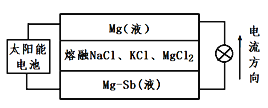
A.该电池放电时,C1-向下层方向移动
B.充电时,阴极的电极反应为:Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层做阴极
D.放电时,Mg(液)层的质量增大
难度: 中等查看答案及解析
-
250C时,向20.0mL0.10mol/L氨水中滴入0.10mol/L盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
A.本实验应选用的指示剂是甲基橙
B.M点处的溶液中c(NH4+)=c(Cl−)>c(H+)=c(OH−)
C.N点处的溶液中pH<12
D.M点对应的盐酸体积为20.0mL
难度: 中等查看答案及解析