-
CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4mo1CO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)⇌N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)⇌N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数K3=__。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
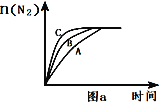
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
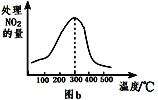
②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___(假设该温度范围内催化效率相同)。
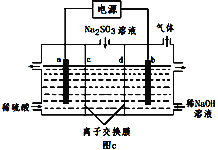
(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__。b为_(阴、阳)极,d离子交换膜为__(阴、阳)离子交换膜。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
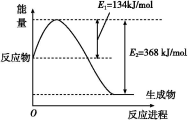
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。
已知:N2(g)+O2(g) 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
2NO(g)+O2(g) 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
则在298 K时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。
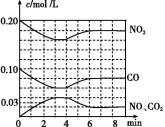
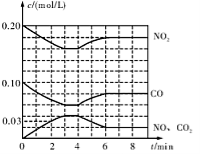
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
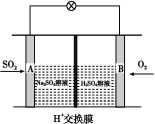
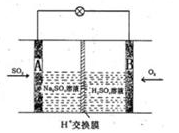
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
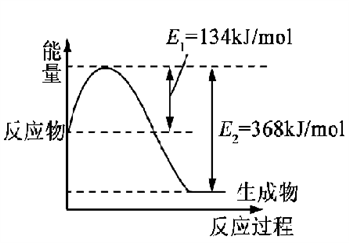
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: ____________________
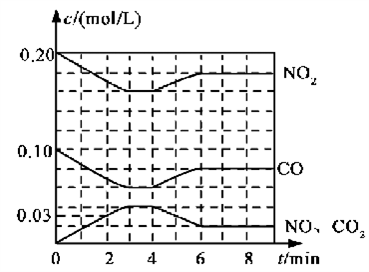
(2)将0.20 mol NO2和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如下图所示。
①下列说法正确的是___________(填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)=__________mol·L-1·min-1
③第4 min时改变的反应条件为__________________。
④计算反应在第6 min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将________移动(填“正向”、“逆向”或“不”)。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图。
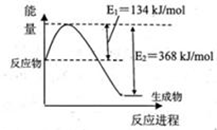
已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则在298k时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=________。
N2(g)+2CO2(g)的△H=________。
(2)将0.20mol NO2和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
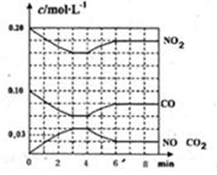
①下列说法正确的是________。(填序号)
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应反应速率增大
②计算产物NO在0~2min时平均反应速率v(NO)=________mol·L-1·min-1;
③第4min时改变的反应条件为________(填“升温”、“降温”);
④计算反应在第6min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为________,当有0.25molSO2被吸收,则通过质子(H+)交换膜的H+的物质的量为________。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSP=2.8×10-9mol2/L2。现将2×10-4mol/L的Na2CO3溶液与一定浓度的CaC12溶液等体积混合生成沉淀,计算应加入CaC12溶液的最小浓度为________。
-
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
A.水体富营养化 B.重金属污染 C.雾霾 D.酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:A的化学式为 ,若生成ag A,理论上可以回收SO2的质量为 g。
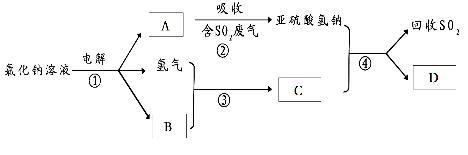
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
-
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有________________________________________________________________________________________________________________________________ (填写字母编号)
A水体富营养化 B重金属污染 C雾霾 D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式________________________________________________________________________________________________ ________________________________________。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式________________________ ________________________,若生成ag A,理论上可以回收SO2的质量为________________________________________________ g。
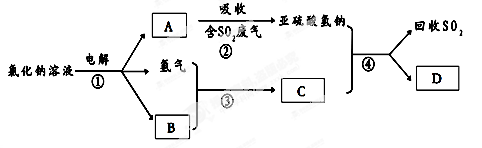
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式________________________________________________________________________________________________________________________ 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式________________________________________________________________________________________________ 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式________________________________________________________________________________________ 。
-
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:________。
(2)已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
①5s内该反应的平均速率ν(NO) = ________(保留2位有效数字);在1300oC 时,该反应的平
衡常数表达式K=________。
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。右图表示在其他条件不变时,反应2NO(g)+2CO(g)  2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的△H________0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
-
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+ O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
②C(s)+ O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N2) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g)  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
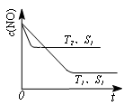
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。

已知:
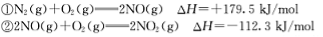
请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。

-
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有________。(填写字母编号)
A.温室效应 B.酸雨 C.粉尘污染 D.水体富营养化
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为________。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
 工业生产中,步骤③的反应条件为________。
工业生产中,步骤③的反应条件为________。
该工艺中物质D可以作为原料循环利用,它的化学式为。
写出步骤②反应的离子方程式。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为。















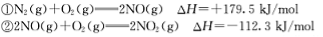


 工业生产中,步骤③的反应条件为________。
工业生产中,步骤③的反应条件为________。