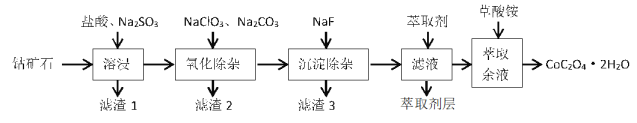
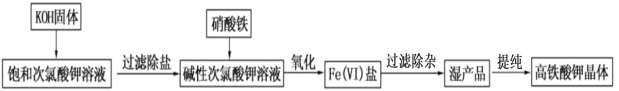
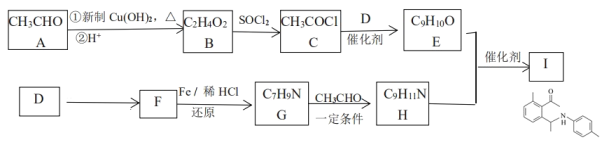
-
化学与生产、生活密切相关,下列有关说法正确的是
A.“84 消毒液”和酒精混合使用可增强杀菌消毒能力
B.通过煤干馏原理可得到苯、二甲苯等有机物
C.纤维素在人体内可水解为葡萄糖,故可作为人体的营养物质
D.铝是地球上含量最多的金属元素,最早被人类大规模开发利用
难度: 简单查看答案及解析
-
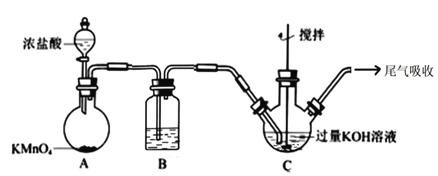
下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项
装置
现象
结论
A
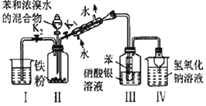
装置Ⅲ中有浅黄色沉淀生成
苯和浓溴水发生取代反应
B
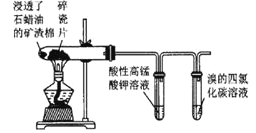
高锰酸钾溶液褪色,溴的四氯化碳溶液褪色
石蜡油的分解产物中含有乙烯
C
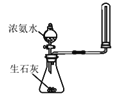
分液漏斗液体流下,锥形瓶中产生大量气体
快速制备和收集一定量的氨气
D
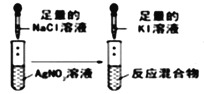
试管中依次出现白色,黄色沉淀
说明 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法错误的是
A.27 g 铝加入足量 1mol/L 的 NaOH 溶液,转移的电子数为 3NA
B.18g 氨基(-ND2)中含有的电子数为 10NA
C.向 100mL0.1mol/L 醋酸溶液中加 CH3COONa 固体至溶液刚好为中性,溶液中醋酸分子数为 0.01NA
D.用惰性电极电解 100mL0.1mol/L 的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时, 电路中转移电子数为 0.04NA
难度: 中等查看答案及解析
-
W、X、Y、Z 均为短周期元素且原子序数依次增大。Y 是短周期中原子半径最大的元素;元素X和Z同族,Z的最高价氧化物对应的水化物的浓溶液与 W 的单质反应,生成两种能使澄清石灰水变浑浊的无色气体。下列说法正确的是
A.简单离子半径大小为 X<Z<Y
B.工业上采用电解法制备单质 X
C.Y 和 Z 的氢化物的沸点中较高的是 Z
D.W 元素与 Z 元素都能形成超过三种的含氧酸盐
难度: 中等查看答案及解析
-
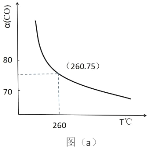
电解法利用 CO2制备甲酸盐可实现 CO2资源化利用, 其装置如图所示:
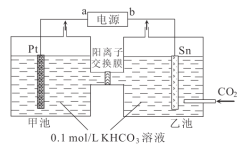
下列说法错误的是
A.a 极为正极,K+由左向右通过交换膜
B.乙池中的反应为 CO2+HCO3-+2e-= HCOO-+ CO32-
C.电解过程中,Pt 电极产生的气体可以用作燃料电池的负极反应
D.两池的溶液 KHCO3浓度均降低
难度: 困难查看答案及解析
-
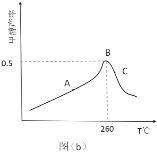
已知 M、N 是合成某功能高分子材料的中间产物,下列关于 M、N 说法正确的是
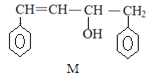
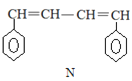
A.M、N 都属于芳香烃,但既不是同系物,也不是同分异构体
B.M、N 分别与液溴混合,均发生取代反应
C.M、N 均能使酸性高锰酸钾溶液褪色
D.M、N 分子所有原子均可能共平面
难度: 中等查看答案及解析
-
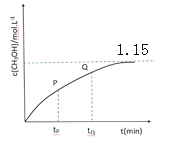
常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
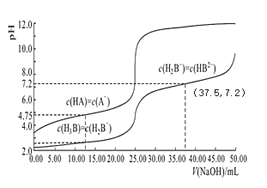
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
难度: 困难查看答案及解析