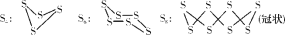-
甲醇是重要的化工原料,也可作燃料。工业上可用CO2和H2在一定条件下合成甲醇。回答下列问题。
(1)已知:CO 和 H2 的燃烧热分别为 283.0 kJ·mol-1、285.8kJ·mol-1 ,水的汽化热为 44.0kJ·mol-1, 反应① CO+H2O=CO2+H2 是生成合成甲醇的原料气(CO2、H2)的重要反应,其热化学方程式为: CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =_____ kJ·mol-1。
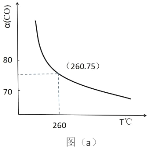
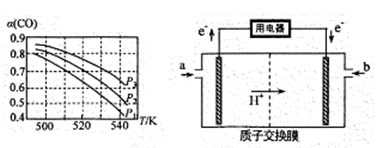
(2)某同学设计实验对反应①进行研究。将 1mol H2O(g)和 1mol CO 充入一个恒容密闭容器中,在催化剂和一定温度下达到化学平衡。如图是 CO 的平衡转化率(%)随温度变化的曲线,260℃时反应①的平衡常数 K=_______。
(3)CO2和 H2在催化剂、一定温度下合成甲醇。图为在容积为 1L 的恒容密闭容器中,加入 3 molH2和 1molCO2时经过相同时间甲醇产率与反应温度的关系曲线:
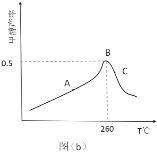
曲线上 A 点_____(填“是”或“不是”)对应温度下的平衡产率,理由是_____,C 点甲醇的产率低于 B 点的原因可能是_____(填标号)。
A.反应活化能增大 B.催化剂活性低 C.副反应多 D.平衡常数变大 E.平衡逆向移动
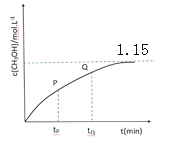
(4)CO和 H2在一定条件下也可以合成甲醇。在容积为1L的恒容密闭容器中,加入 a molH2和2.0molCO,在催化剂和 260℃温度条件下发生反应:CO+2H2=CH3OH。图为甲醇的浓度与反应时间的关系曲线,tP 时的 v 逆_____tQ 时的 v 逆(填大于、小于或等于),判断的依据是_____,达平衡时氢气的浓度为 1.0mol/L,则起始时加入的氢气的物质的量为_____mol。
-
甲醇是有机化工原料合优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题。
(1)工业上可用CO2和H2反应合成甲醇。
已知25℃、101kPa下: ①CO(g) +3H2(g)=CH3OH(l) +H2O(1) △H1=-132kJ• mol-1
②2H2(g) +O2(g)==2H2O(g) △H2= -484 kJ• mol-1
③H2O(l)= H2O(g) △H3= + 44 kJ• mol-1写出表示CH3OH燃烧热的热化学方程式:_______________。
(2)合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g) H2 (g)+CO2(g) △H<0。
H2 (g)+CO2(g) △H<0。
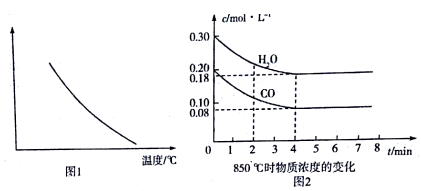
①在恒容密闭容器中.通入一定设的CO和H2O(g)发生上述反应,图1所示的是该反应的相关量值随溫度变化的情况,下列量值符合图示的是_______。
a.平衡常数 b.反应物的平衡转化率 c.逆反应速率 d. H2O(g)的平衡浓度
②850℃时,若通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图2所示,达到平衡时H2O(g)的转化率为 ___________,该条件下的平衡常数K=___________。
(3)CO和H2反应也能合成甲醇:CO(g) +2 H2 (g) CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
(4) 甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数Ka =1.0×10-4,20.00mL0.100 0mol·L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中 c(HCOOH) = c(HCOO-) , c(OH-) =_______,溶液中离子浓度由大到小的顺序为_______。
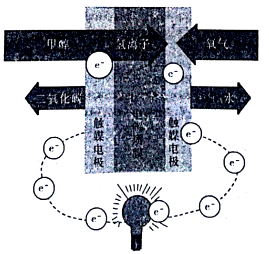
(5)甲醇燃料电池(如图所示)是质子交换膜燃料电池的一种变种,它直接使用甲醇而无须预先重整。写出在该条件下,甲醇燃料电池的负极反应式:_______________。
-
在一定条件下,CO2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
已知:
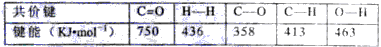
该反应△H=________KJ/mol。
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
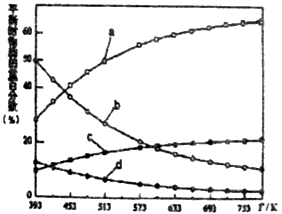
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= ________;
②曲线a表示的物质为H2,理由是________;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________(列举2项).
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________。
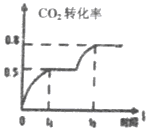
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2  CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
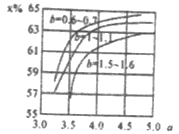
①b宜控制在________(填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.61;
②a宜控制在4.0左右,理由是________。
(4) 工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)  CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 mo1CO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V= ________ mL。
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 mo1CO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V= ________ mL。
-
甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+ O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a. 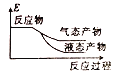 b.
b. 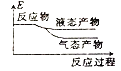 c.
c. 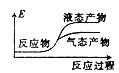 d.
d. 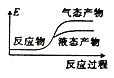
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.1kJ•mol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L﹣1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
| H2 | x | 0.12 | 0.12 | 0.2 | …… |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000mol•L﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
-
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
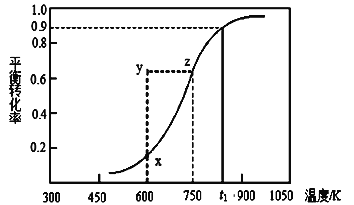
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
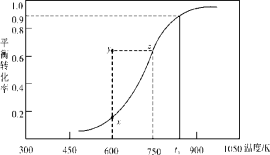
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
-
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
-
甲醇(CH3OH)是一种重要的化工原料,既可用于化工生产,也可直接用做燃料。
(1)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为___________。
(2)甲醇也可由CO与H2反应制得。在一定温度下,初始容积相同的两个容器中(如图),发生反应: CO(g)+2H2(g)=CH30H(g)。
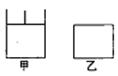
① 能表明甲和乙容器中反应一定达到平衡状态的是________(填字母代号)。
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.CO的质量分数保持不变 D. CO 与H2的转化率之比为3 : 2
E.v(CO)=v(CH30H)
②两容器中反应达到平衡时,Co的转化率α甲______α乙(填“>”、“< ”或“=”)
(3)组成n(H2)/n(CO+CO2)=2.60时,体系中CO 的平衡转化率(α)动与温度和压强的关系如图所示。图中的压强由大到小依次为_______,其判断理由是______________。
(4)甲醇燃料电池(简称DMFC)可作为常规能源的替代品而备受关注。DMFC的工作原理如图所示:
① 加入a 物质的电极是电池的______(填“正”或“负”)极,其电极反应式为________.
② 常温下以该装置作电源,用惰性电极电解NaCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,两电极均得到0.14mol的气体。若电解后溶液体积为4OL,则电解后溶液的pH 为________。
-
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
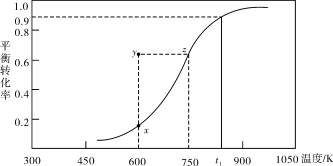
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;
实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,
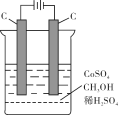
则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程为 。
-
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
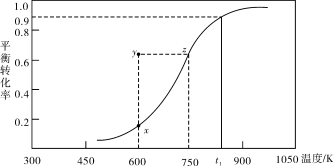
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度
T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程式为 。
-
研究反应过程的热量变化对于生产生活有重要意义。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。
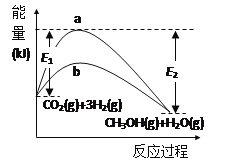
A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
则ΔH3=____。
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
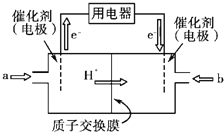
则通入a气体的电极是电池的____(填“正”或“负”)极,其电极反应式为___。
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:
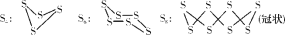
(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于_____。
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为_____。










 b.
b.  c.
c.  d.
d.