-
甲醇是有机化工原料合优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题。
(1)工业上可用CO2和H2反应合成甲醇。
已知25℃、101kPa下: ①CO(g) +3H2(g)=CH3OH(l) +H2O(1) △H1=-132kJ• mol-1
②2H2(g) +O2(g)==2H2O(g) △H2= -484 kJ• mol-1
③H2O(l)= H2O(g) △H3= + 44 kJ• mol-1写出表示CH3OH燃烧热的热化学方程式:_______________。
(2)合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g) H2 (g)+CO2(g) △H<0。
H2 (g)+CO2(g) △H<0。
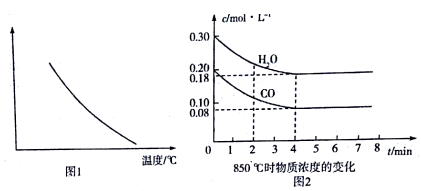
①在恒容密闭容器中.通入一定设的CO和H2O(g)发生上述反应,图1所示的是该反应的相关量值随溫度变化的情况,下列量值符合图示的是_______。
a.平衡常数 b.反应物的平衡转化率 c.逆反应速率 d. H2O(g)的平衡浓度
②850℃时,若通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图2所示,达到平衡时H2O(g)的转化率为 ___________,该条件下的平衡常数K=___________。
(3)CO和H2反应也能合成甲醇:CO(g) +2 H2 (g) CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
(4) 甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数Ka =1.0×10-4,20.00mL0.100 0mol·L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中 c(HCOOH) = c(HCOO-) , c(OH-) =_______,溶液中离子浓度由大到小的顺序为_______。
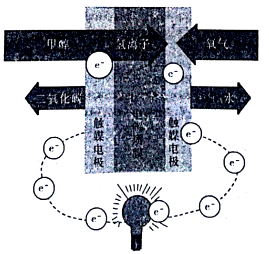
(5)甲醇燃料电池(如图所示)是质子交换膜燃料电池的一种变种,它直接使用甲醇而无须预先重整。写出在该条件下,甲醇燃料电池的负极反应式:_______________。
-
甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+ O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a. 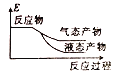 b.
b. 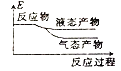 c.
c. 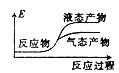 d.
d. 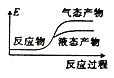
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.1kJ•mol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L﹣1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
| H2 | x | 0.12 | 0.12 | 0.2 | …… |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000mol•L﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)  CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g)  CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
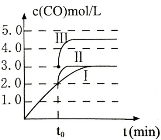
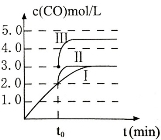
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
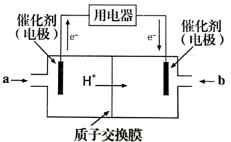
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:反应①:CO(g)+2H2(g)  CH3OH(g) △H1=-90.77kJ/mol 反应②:CO2(g)+H2(g)
CH3OH(g) △H1=-90.77kJ/mol 反应②:CO2(g)+H2(g)  CO(g)+H2O(g) △H2 反应③:CO2(g)+3H2(g)
CO(g)+H2O(g) △H2 反应③:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_________(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
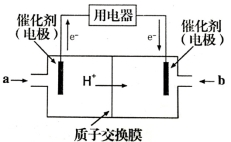
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。
已知甲醇制备的有关化学反应如下
反应①:CO(g)+2H2(g)=CH3OH(g) △H1=﹣90.77kJ•mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=﹣49.58kJ•mol-1
(1)反应②的△H2=_________ kJ•mol-1。 。
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=______(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时 V正________V逆(填“>”、“=”或“<”=。
(3)在3L密闭容器中发生反应②,c(CO)随反应时间t变化如图1中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________。
当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为______________。
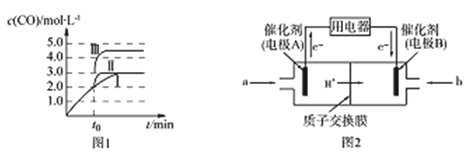
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图2所示,则电极A的电极反应式为_________________________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与bmol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示醋酸的电离常数为____________________。
-
环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
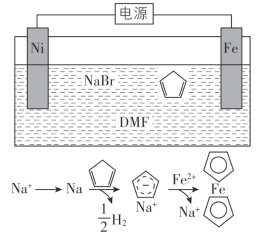
该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
-
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)判断反应达到平衡状态的依据是( )
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q________0 (填“>”、“ ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是( )
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v ________mol /(L·min),
________mol /(L·min),
CO的转化率为________。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s) CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s) H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2 、K3之间的关系是:________。
-
水合肼 是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为
是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为 。某同学在实验室模仿工业制备方法制备
。某同学在实验室模仿工业制备方法制备 。回答下列问题:
。回答下列问题:
(1) 溶液的制备,装置如图所示。
溶液的制备,装置如图所示。
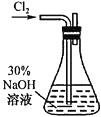
①实验室利用二氧化锰和浓盐酸制备氯气的离子方程式为_________________。
②实验需要用到 的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
③锥形瓶中发生反应的化学方程式为___________________________。
④因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液中NaOH的浓度。利用所提供试剂,设计实验方案:____________________________所提供的试剂有: 溶液、
溶液、 溶液、
溶液、 的盐酸、酚酞试液。
的盐酸、酚酞试液。
(2)水合肼的制备,装置如图所示。
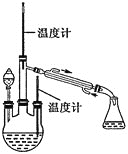
实验步骤:控制反应温度 加热装置已省略
加热装置已省略 ,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集
,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集 馏分于锥形瓶中。已知
馏分于锥形瓶中。已知 。分液漏斗中的溶液是_________
。分液漏斗中的溶液是_________ 填“
填“ 溶液”或“NaOH和NaClO混合溶液”
溶液”或“NaOH和NaClO混合溶液” ,选择的理由是___________。
,选择的理由是___________。
(3)馏分中水合肼含量的测定。
称取馏分 ,加入适量的
,加入适量的 固体
固体 滴定过程中,控制溶液的pH保持在
滴定过程中,控制溶液的pH保持在 左右
左右 ,加水配成
,加水配成 溶液,移出
溶液,移出 ,用
,用 的
的 溶液滴定。实验测得消耗
溶液滴定。实验测得消耗 溶液的平均值为
溶液的平均值为 ,馏分中水合肼
,馏分中水合肼 的质量分数为_____。
的质量分数为_____。 已知:
已知:
-
氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸( ,含有少量
,含有少量 、
、 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知: ):
):
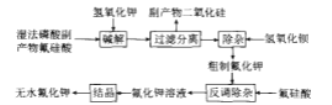
请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。
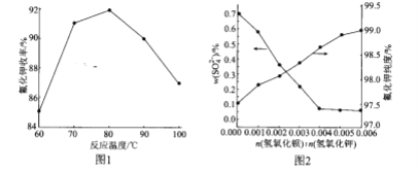
(3)Ba(OH)2加入量对 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中 ___[已知
___[已知 ,
, ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子 ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
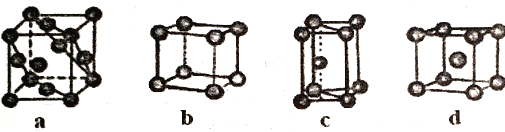
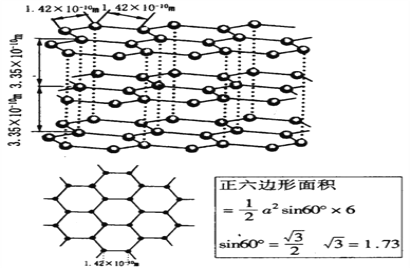
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
 b.
b.  c.
c.  d.
d. 













