-
2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。以下是人们在面对新型冠状病毒肺炎时的一些认识,其中正确的是()
A.新型冠状病毒由C、H、O三种元素组成
B.过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
C.防护服、口罩的制备均要用到有机高分子材料
D.84消毒液是以NaClO为主要有效成分的消毒液,为了提升消毒效果,可以用热水配制
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法中,不正确的是( )
A.一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1NA
B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜
C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA
D.标准状况下,锌与某浓度的H2SO4反应生成11.2 L气体,反应中转移的电子数为6.02×1023
难度: 中等查看答案及解析
-
用来减轻感冒症状的布洛芬的结构简式如下图所示,下列有关说法错误的是( )
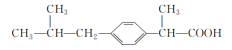
A.1 mol布洛芬能与足量NaHCO3溶液反应最多生成1 mol CO2
B.布洛芬的分子式为C13H20O2
C.布洛芬苯环上的一溴代物有2种
D.布洛芬与苯乙酸是同系物
难度: 中等查看答案及解析
-
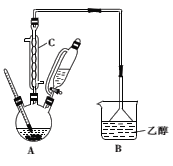
下列实验操作能达到实验目的的是( )
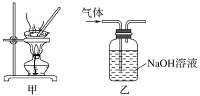
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol•L-1 NaOH溶液
C.用装置甲蒸干AlCl3溶液制无水AlCl3固体
D.用装置乙除去实验室所制乙烯中的少量SO2
难度: 中等查看答案及解析
-
一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
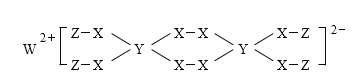
A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.该漂白剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物为弱酸
难度: 简单查看答案及解析
-
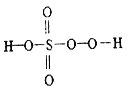
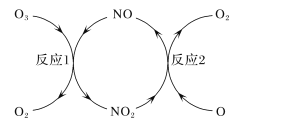
研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
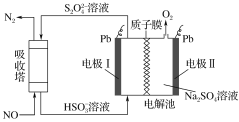
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
难度: 中等查看答案及解析
-
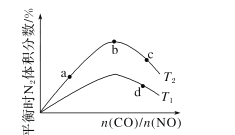
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,下列说法错误的是()
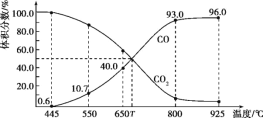
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡向正反应方向移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
难度: 中等查看答案及解析
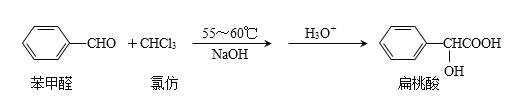
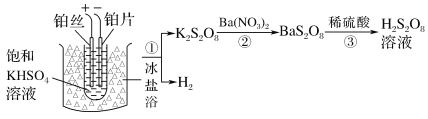
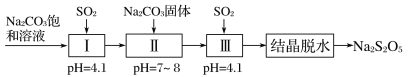
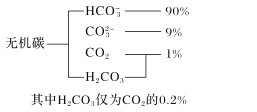
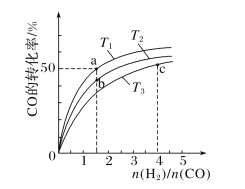
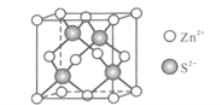
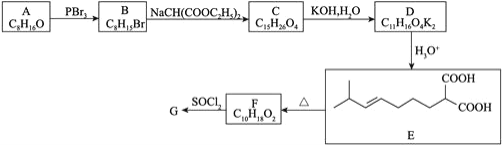
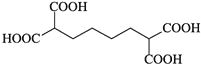 的合成路线_______________。
的合成路线_______________。