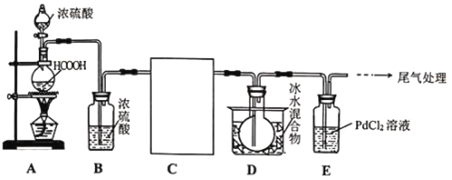
-
2020年5月新修订的《北京市生活垃圾管理条例》将正式实施,垃圾分类并回收利用,可以减少污染,保护环境,节约自然资源,而环境保护与化学知识息息相关,下列有关说法正确的是( )
A.废旧电池中含有镍、镉等重金属,不可用填埋法处理,属于有害垃圾
B.各种玻璃制品的主要成分是硅酸盐,不可回收利用,属于其他(干)垃圾
C.废弃的聚乙烯塑料属于可回收垃圾,不易降解,能使溴水褪色
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.28g乙烯和丙烯中的极性键数目为4NA
B.1.0molCH4与Cl2在光照下反应生成CH3Cl分子数为1.0NA
C.1mol氖气中含有的原子总数为2NA
D.0.1L0.1mol•L-1MgCl2溶液中的Mg2+数目为0.01NA
难度: 中等查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
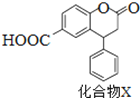
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.化合物X不能发生氧化反应
难度: 中等查看答案及解析
-
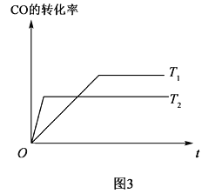
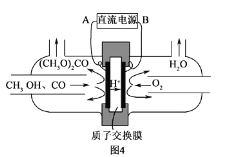
以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是
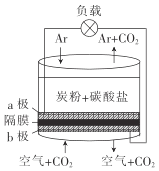
A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
难度: 中等查看答案及解析
-
下列实验操作及现象和后面结论对应正确的是
选项
实验操作
现象
结论
A
火柴梗上滴少量的浓硫酸
火柴梗变黑
浓硫酸具有强氧化性
B
向淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入银氨溶液
无银镜出现
不能判断是否水解
C
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色,最后有白色沉淀
非金属性:Cl>Si
D
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
已知:pAg=-lg c(Ag+),pX=-lg c(Xn-)。298 K时,几种物质的Ksp如下表:
化学式
AgCl
AgSCN
Ag2CrO4
颜色
白
浅黄
红
Ksp
1.8×10‒10
1.0×10‒12
2.0×10‒12
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
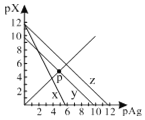
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298 K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298 K时Ag2CrO4(s)+2SCN-(aq)
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
难度: 中等查看答案及解析
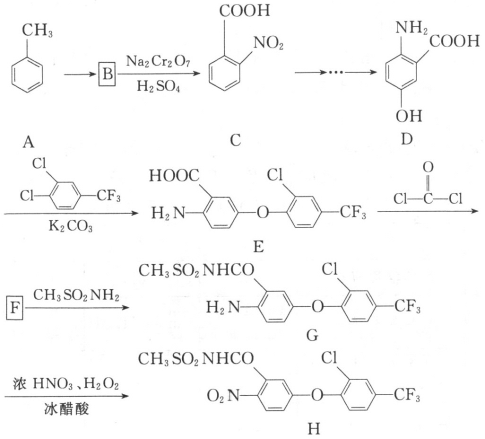
 的合成路线流程图___。
的合成路线流程图___。