-
镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g) Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
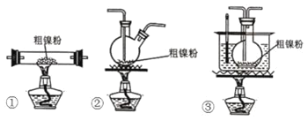
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
①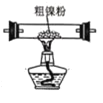 ②
②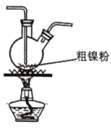 ③
③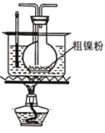
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
-
镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g) Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。
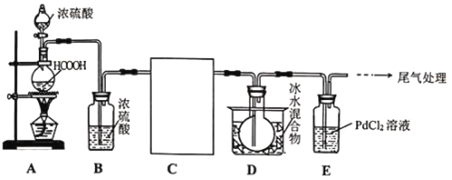
回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。
(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__mol•L-1(填实验现象再加热C装置)。
-
目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
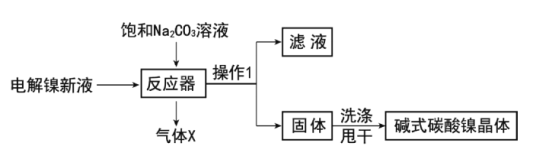
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
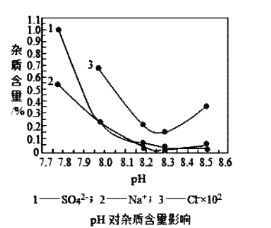
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。
(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:
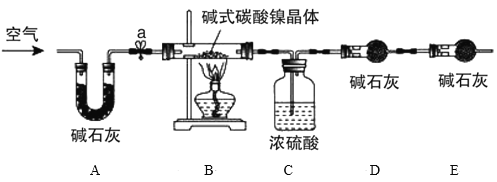
资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
| 装置C/g | 装置D/g | 装置E/g |
| 加热前 | 250.00 | 190.00 | 190.00 |
| 加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:
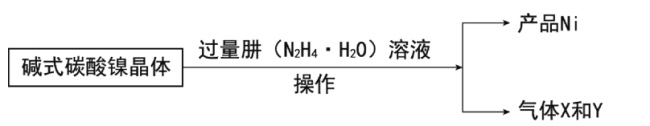
(7)写出制备Ni的化学方程式__。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力.
(1)基态Ni原子的核外电子排布式为______.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式为______.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
(4)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为______;Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为______;
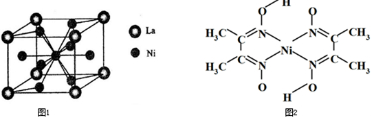
(6)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键______.
-
高纯镍常用作加成反应的催化剂,制取原理:Ni(s)+4CO(g) Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:

(1)装置A中发生反应的化学方程式为__________________。
(2)装置C用于合成Ni(CO)4(夹持装置略),最适宜选用的装置为__________________(填标号).
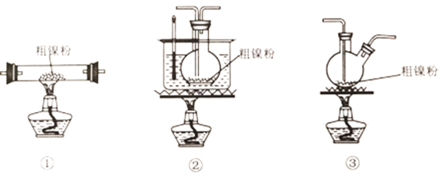
(3)实验过程中,必须先观察到__________________(填实验现象)才加热C装置,原因是__________________。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__________________(填标号).
A.分液 B.过滤 C.蒸馏 D.蒸发浓缩、冷却结晶
(5)利用“封管实验“原理也可冶炼高纯镍。如图所示的石英玻璃封管中充有CO气体,则不纯的镍(Ni)粉应放置在封管的__________________温度区域端(填“323K”、“473K”)

(6)实验中加入6.90gHCOOH,C装置质量减轻1.18g(设杂质不参加反应,)E装置中盛有PdCl2溶液200mL.则PdCl2溶液的物质的量浓度至少为__________________mol••L-1。
-
三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
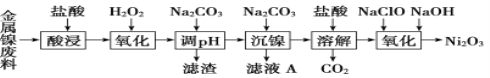
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
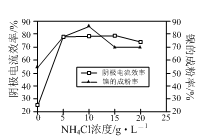
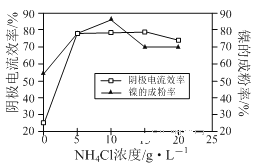
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
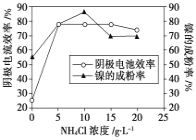
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
-
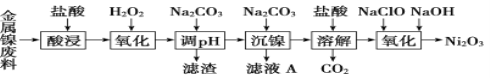
三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
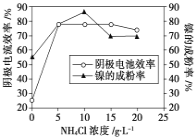
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
-
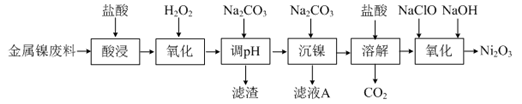
三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为___________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和___________。
(4)“氧化”生成Ni2O3的离子方程式为___________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如右图所示,则NH4Cl的浓度最好控制为___________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为 ___________。
-
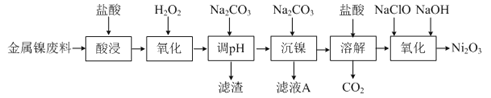
I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。
II、煤制天然气的工艺流程简图如下:
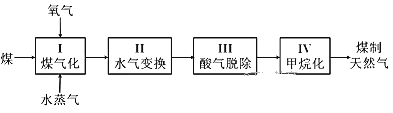
(4)已知反应I:C(s)+H2O(g) CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g) 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的 H=______。
H=______。

-
“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 |
| Ksp | 6×10-36 | | | 3×10-19 | |
| pH | 开始沉淀 | | 4.7 | 7.2 | | 1.9 |
| 沉淀完全 | | 6.7 | 9.2 | | 3.2 |
| | | | | | |
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
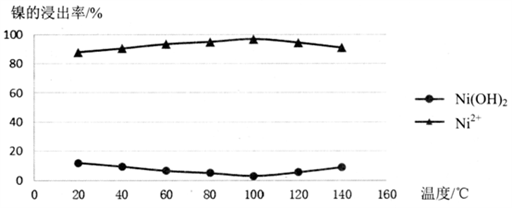
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。
(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。




 ②
② ③
③




















