-
下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是
A.燃烧煤炭供热 B.利用风力发电 C.增加植被面积 D.节约用电用水
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为10的氧原子:
B.Mg2+的结构示意图:
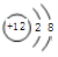
C.硫化钠的电子式:
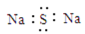 D.乙醇的结构简式:C2H6O
D.乙醇的结构简式:C2H6O难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是
A.元素X、W的简单阴离子具有相同的电子层结构
B.原子半径:r(X)<r(Y)<r(Z)<r(W)
C.W的简单气态氢化物的热稳定性比Y的强
D.由Y、Z两种元素组成的化合物是离子化合物
难度: 中等查看答案及解析
-
下列实验方法、结论不正确的是
A.向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,该溶液中不一定含有SO42-
B.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定不含K+
C.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.硝酸钾固体中含少量氯化钾:配制80℃的饱和溶液,冷却结晶、过滤、洗涤、干燥
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是
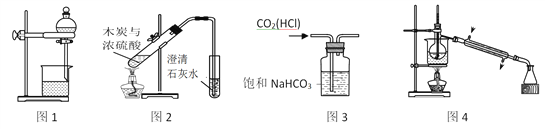
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
难度: 简单查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol-1
A.反应①中电能转化为化学能
B.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8kJ·mol-1
C.反应③使用催化剂,ΔH3减小
D.反应②为放热反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,pH=2的H2SO4溶液中,含有H+的数目为2×10-2NA
B.一定条件下,1molN2与3molH2混合充分反应,转移电子数目为6NA
C.常温下,1.0L0.1mol·L-1FeCl3溶液中,Fe3+的数目为0.1NA
D.用石墨电极电解足量CuSO4溶液,当阴极析出6.4gCu时,转移电子数目为0.2NA
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.Kw/c(H+)=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
B.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
C.与A1反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol/L的溶液中: K+、Na+、A1O2-、CO32-
难度: 中等查看答案及解析
-
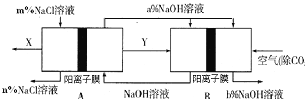
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
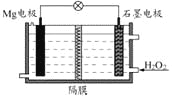
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.HCO3-水【解析】
HCO3-+H2O⇌CO32-+H3O+B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
D.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO
=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g),常压下该反应在1900℃的高温下才能进行,说明该反应的ΔH<0
B.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
C.将MgCl2·6H2O在坩埚中加热可获得MgCl2
D.反应2H2(g)+O2(g)
2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和−反应中断裂旧共价键的键能之和
难度: 中等查看答案及解析