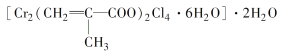-
聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。该过程中反应温度不宜过高,原因是_______;H2O2氧化Fe2+的离子方程式为________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2mol·L−1K2Cr2O7溶液滴定至终点(滴定过程中 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将_______(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____________。
-
(16)聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
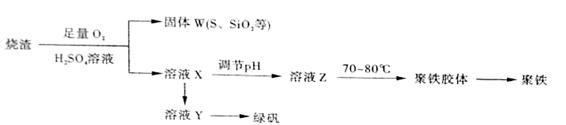
(1)验证固体W焙烧后产生的气体含有SO2 的方法是_____。
(2)实验室制备、收集干燥的SO2 ,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a


 f装置D的作用是_____,装置E中NaOH溶液的作用是______。
f装置D的作用是_____,装置E中NaOH溶液的作用是______。
(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
-
实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:

下列说法不正确的是( )
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
-
实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
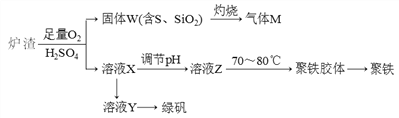
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
-
硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:
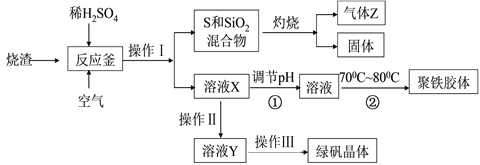
请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
-
硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
-
铁是重要的金属元素,用途极广。
(1)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为__________。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ/mol
高炉炼铁过程中发生的主要反应为:
1/3Fe2O3(s)+ CO(g)  2/3Fe(s)+CO2(g) ΔH = a kJ/mol,则a =_____kJ/mol。
2/3Fe(s)+CO2(g) ΔH = a kJ/mol,则a =_____kJ/mol。
已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 ________v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= ______________。欲提高上述反应中CO的平衡转化率,可采取的措施是______________;
A.提高反应温度 B.移出部分CO2 C.加入合适的催化剂 D.减小容器的容积
-
聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.02000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a:b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
A.2:1 B.3:1 C.2:5 D.1:1
-
聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
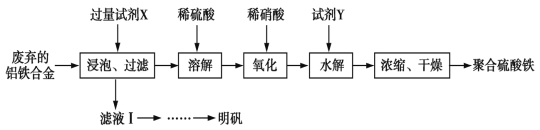
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
-
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| | Mn | Fe |
| 电离能 | I1 | 717 | 759 |
| (kJ·mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为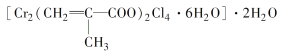
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。