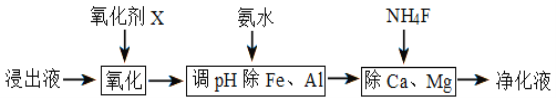
-
生活环境逐渐恶化,人们日益重视环境问题,下列做法或说法正确的是( )
A.推广使用无磷洗衣粉,以减少水体富营养化
B.PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
C.为提高农作物产量大量使用农药和化肥
D.对农作物秸秆进行焚烧还田,以增加土壤肥力
难度: 中等查看答案及解析
-
除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A.Na2CO3 AgNO3 HNO3 B.AgNO3 Na2CO3 HCl
C.AgNO3 K2CO3 HNO3 D.AgNO3 Na2CO3 HNO3
难度: 中等查看答案及解析
-
对于某些离子的检验及结论正确的是 ( )
A.加氢氧化钠溶液加热产生的气体使湿润红色石蕊试纸变蓝,原溶液中一定有
B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有Ag+
C.加盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,原溶液中一定有
D.加入少量的氢氧化钠后溶液中产生白色沉淀,原溶液中一定有Mg2+
难度: 中等查看答案及解析
-
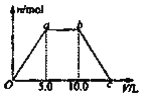
Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22-。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )
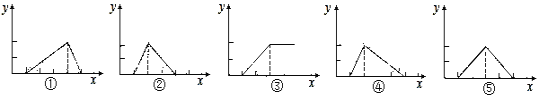
A.②③④ B.⑤③① C.⑤③④ D.②③①
难度: 中等查看答案及解析
-
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是( )
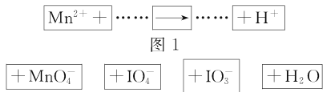
A.
作氧化剂 B.若有
参加反应转移
电子
C.氧化剂与还原剂的物质的量之比为5∶2 D.配平后
、
的化学计量数分别为2、3
难度: 简单查看答案及解析
-
下列离子方程式的书写及评价,均合理的是( )
选项
离子方程式
评价
A
将2 molCl2通入含1 molFeI2的溶液中:2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3-+OH-===BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入NaClO溶液中:SO2+H2O+ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
将等体积的3.5mol/L的HCl溶液,逐滴加入到1 mol/L的NaAlO2溶液中:6AlO2-+21H+==5Al3++Al(OH)3↓+9H2O
正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶5
A. A B. B C. C D. D
难度: 简单查看答案及解析