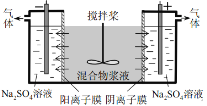
-
化学与生产、生活密切相关,下列说法不正确的是
A.用热的纯碱溶液去除油污
B.用Na2S处理废水中的Cu2+、Hg2+等重金属离子
C.明矾水解时产生具有吸附性的胶体粒子,可作净水剂
D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
难度: 简单查看答案及解析
-
下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为放热反应
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
难度: 简单查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是
A.室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶【解析】
Mg(OH)2+2NH4+=Mg2++2NH3·H2OD.向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
难度: 中等查看答案及解析
-
下列实验操作正确的是
A.用pH试纸测定NaClO溶液的pH
B.电解饱和MgCl2溶液制取金属镁
C.用酸式滴定管量取20.00mL KMnO4溶液
D.滴定前用待测液润洗锥形瓶
难度: 简单查看答案及解析
-
下列说法正确的是
A.第一电离能:Cl>S>P
B.共价键的极性:HF>HCl>HBr
C.键角:H2O>NH3>CH4
D.酸性:HClO>HClO2>HClO3
难度: 简单查看答案及解析
-
下列分子或离子的立体构型相同的是
A.BeCl2和SO2 B.BF3和PCl3 C.SO42-和NH4+ D.SO3和ClO3-
难度: 简单查看答案及解析
-
下列说法正确的是
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.含有极性键的分子一定是极性分子
C.丙氨酸(
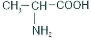 )存在手性异构体
)存在手性异构体D.NaCl熔化和CO2气化克服的作用力类型相同
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
A.原子半径:W<X B.常温常压下,Y单质为固态
C.最高价氧化物对应水化物的酸性:Y<Z D.X的最高价氧化物的水化物是强碱
难度: 简单查看答案及解析
-
一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g),下列说法正确的是
容器
温度/K
物质的平衡浓度/mol/L
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
I
400
0.20
0.10
0
0.080
II
400
0.40
0.20
0
III
500
0
0
0.10
0.025
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
难度: 中等查看答案及解析
-
常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。下列说法不正确的是
A.浓度均为0.1mol·L-1的HCOONa和CH3COONa溶液中离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者小于后者
C.0.2mol·L-1 HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1 CH3COONa 与 0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
难度: 中等查看答案及解析
-
常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是
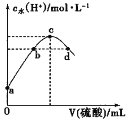
A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
难度: 困难查看答案及解析
-
用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.1mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
难度: 简单查看答案及解析