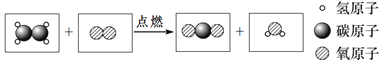
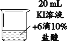-
向硝酸铜、硝酸银和硝酸镁的混合溶液中加入一定质量的金属锌,充分反应后,过滤,得到滤渣和滤液,以下推断正确的是( )
A. 若滤液为蓝色,则滤渣中一定有银和铜
B. 若向滤液中加入稀盐酸无白色沉淀生成,则滤渣中一定有银和铜
C. 若向滤渣中加入稀盐酸有气泡生成,则滤液中只含有硝酸镁和硝酸锌
D. 若反应前加入的金属锌的质量和反应后滤渣的质量相等,则滤渣中一定不含锌和镁
难度: 中等查看答案及解析
-
下列选项中各种溶质的溶液混合,无明显现象的是( )
A. NaOH、NH4Cl、Fe2(SO4)3 B. KNO3、AgNO3、NaCl
C. KCl、CH3COOH、Na2CO3 D. H2SO4、K2SO4、HNO3
难度: 中等查看答案及解析
-
“我是碳族的大女儿,让大地充满生机,让地球因我而温暖;我调皮可爱,钻进石灰水,搅得人家不安宁;我藏在汽水里,小朋友喝了直打嗝。”这里叙述中的“我”是指
A. 二氧化碳 B. 氧气 C. 氮气 D. 稀有气体
难度: 简单查看答案及解析
-
下列知识整理的内容正确的是
A. 进入地窖前——先做灯火实验
B. 煤、石油等化石能源——可再生的重要战略资源
C. 人体适量补钙——防止患甲状腺疾病
D. 森林大火的灭火原理——降低可燃物着火点
难度: 简单查看答案及解析
-
绚烂多姿的“冰晕”装点着美丽的天空,它是大气中冰晶对光线反射或折射所产生的大气光学现象,“冰晶”是水蒸气冷却后变成的固体小颗粒。“冰晕”和“冰晶“的形成过程发生的变化是( )

A. 均为物理变化
B. 均为化学变化
C. 前者是物理变化,后者是化学变化
D. 前者是化学变化后者是物理变化
难度: 简单查看答案及解析
-
下列装置有误或不能完成对应实验的是( )
A. 用于过滤粗盐水中的泥沙杂质
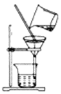
B. 用于食盐水的蒸发结晶
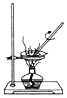
C. 用于实验室即关即停制取H2
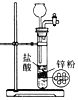
D. 用于除去H2中的HCl杂质
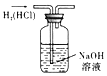
难度: 中等查看答案及解析
-
已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕(Eu)原子的相对原子质量为152,铕(Eu)原子的质量为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
“众志成城战疫情”,在抗击新型冠状病毒引发的肺炎疫情中大量使用84消毒液来进行消毒,84消毒液的主要成分是次氯酸钠(NaC1O)。下列关于次氯酸钠的说法中不正确的是( )
A.次氯酸钠中氯元素的化合价为+5价
B.次氯酸钠中氧元素的质量分数最小
C.次氯酸钠中钠、氯、氧三种元素的质量比为46:71:32
D.次氯酸钠由钠、氯、氧三种元素组成
难度: 中等查看答案及解析
-
在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是
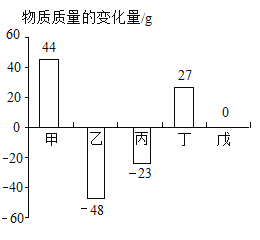
A.该反应一定属于化合反应或分解反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48:23
D.该反应中甲、丁的相对分子质量之比一定为44:27
难度: 中等查看答案及解析
-
提升“中国芯”的性能是我国信息产业的当务之急。“中国芯”的核心材料是高纯度的单质硅,工业上制取粗硅的化学方程式为:SiO2+2C
Si+2CO↑,下列说法正确的是
A. 硅元素在地壳中的含量比氧元素多 B. 该反应的基本类型为置换反应
C. 在此反应中硅元素的化合价升高 D. 该反应体现了碳的氧化性
难度: 中等查看答案及解析
-
如图为金刚、石墨和C60的结构模型图,图中小球代表碳原子。下列说法不正确的是( )
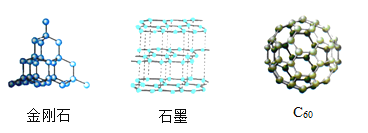
A. 原子的排列方式改变,则构成的物质种类改变
B. 相同元素组成的不同物质,在足量的氧气中完全燃烧,产物相同
C. 相同元素组成的不同物质,化学性质相同
D. 在特定的条件下,石墨既可转化为金刚石,也可转化为C60
难度: 中等查看答案及解析
-
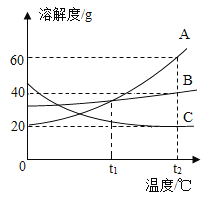
如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
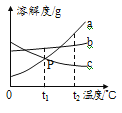
A. a的溶解度大于b的溶解度
B. P点表示t1℃时a、c两物质溶解度相等
C. 将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液
D. 将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质最分数由大到小的顺序为:b>a=c
难度: 中等查看答案及解析
-
某同学选用氢氧化钠固体与水配制20g溶质质量分数为10%的氢氧化钠溶液,下列说法错误的是( )
①需称取氢氧化钠固体2.0g
②称量前托盘天平应先检查游码是否归零,并调节平衡
③用托盘天平称量氢氧化钠固体时,为防止污染托盘,可将氢氧化钠放在纸上称量
④选用250mL量筒量取18mL的水
⑤存放溶液时,为确保数据准确,将试剂瓶用蒸馏水清洗后,立即倒入所配溶液封存
A.
B.
C.
D.
难度: 中等查看答案及解析
-
盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入 10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是( )
A.5.6g 铁和锌
B.10g 镁和氧化镁
C.10g 碳酸镁
D.10g 碳酸镁和碳酸锌
难度: 中等查看答案及解析
-
某小组同学分别完成了图1 所示的3 个实验(图中a 处连接压强传感器).图2 中的曲线1, 2,3 分别表示加入等体积相应液体后,烧瓶 1, 2, 3 内压强随时间的变化趋势。下列说法不正确的是
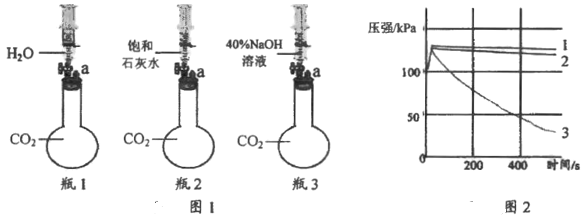
A. 由于注入液体压缩了瓶内的气体,所以三个实验的起始阶段压强都快速增大
B. 对比曲线 1 和 2 可知,二氧化碳和水一定发生了化学反应
C. 对比曲线 1 和 3 可知,二氧化碳和氢氧化钠一定发生了化学反应
D. 对比曲线 2 和 3 可知,40% NaOH 溶液比饱和石灰水更适合吸收二氧化碳
难度: 困难查看答案及解析