-
波音787型飞机的机身和机翼大量使用下列哪种材料( )
A. 液晶高分子材料 B. 橡胶
C. 高分子分离膜 D. 碳纤维复合材料
难度: 简单查看答案及解析
-
将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
A. c(Cl-)>c(NH4+)>c(OH-)>c(H+) B. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c(Cl-)=c(NH4+>c(H+)=c(OH-) D. c(NH4+)>c(Cl-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
在有机物的研究过程中,能测出有机物相对分子质量的仪器是( )
A. 红外光谱仪 B. 元素分析仪 C. 质谱仪 D. 核磁共振仪
难度: 简单查看答案及解析
-
已知某可逆反应:mA(g) + nB(g)
pC(g) ∆H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
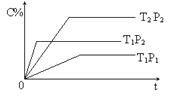
A. T1<T2 P1>P2 m+n<P Q<0 B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0 D. T1>T2 P1<P2 m+n>P Q<0
难度: 中等查看答案及解析
-
在恒温、恒容下,有下列气体反应分别从两条途径进行:
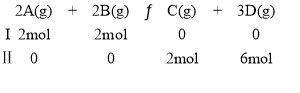
下列叙述正确的是( )
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的浓度相同
C.达到平衡时,Ⅰ途径所用的时间与Ⅱ途径所用的时间相同
D.达到平衡时,Ⅰ途径混合气体密度等于Ⅱ途径混合气体的密度
难度: 中等查看答案及解析
-
用石墨作电极,电解2 mol·L-1CuSO4溶液时,下列变化不可能发生的是( )
A.阳极附近H+浓度增大 B.阴极质量增加
C.阴极上放出氧气 D.溶液蓝色变浅
难度: 中等查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,v的单位为[mol/(L·min)]。下列判断错误的是( )
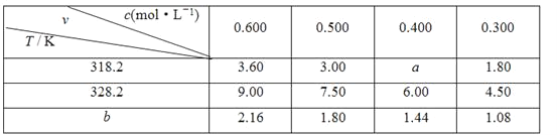
A.318.2 K,蔗糖起始浓度为0.400 mol/L,10 min后蔗糖浓度略大于0.376 mol/L
B.bK时,若蔗糖的浓度为0.35 mol/L,则v=1.26 mmol/(L·min)
C.b<318.2
D.若同时改变反应温度和蔗糖的浓度,则v肯定变化
难度: 中等查看答案及解析
-
不久前,美国一个海军航空站安装了一台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2,则下列推断正确的是( )
A.正极反应为4OH-=O2+2H2O+4e-
B.放电时CO32-向负极移动
C.电池供应1 mol水蒸气,转移的电子数为4 mol
D.放电时CO32-向正极移动
难度: 中等查看答案及解析
-
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+) D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的体积相等,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸中有锌剩余 ⑥醋酸中有锌剩余
A.③④⑤ B.③④⑥ C.②③⑤ D.②③⑤⑥
难度: 中等查看答案及解析
-
已知化学反应2C(s)+O2(g)
2CO(g);2CO(g)+O2(g)
2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
A.56 g CO和32 g O2所具有的总能量之和大于88 g CO2所具有的总能量
B.12 g C所具有的能量一定高于28 g CO所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将两份质量相等的碳完全燃烧,生成CO2的反应比生成CO的反应放出的热量多
难度: 中等查看答案及解析
-
在进行中和热的测定中,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
难度: 简单查看答案及解析
-
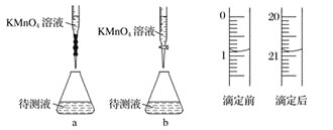
已知c(NH4Cl)<0.1 mol/L时溶液pH>5.1,现在用0.1 mol/LHCl滴定10 mL 0.05 mol/L的氨水,用甲基橙作指示剂,达到终点时所用HCl的量应是( )
A.10 mL B.5 mL C.小于5 mL D.大于5 mL
难度: 中等查看答案及解析
-
某二元弱酸H2A溶液,按下式发生电离:H2A
H++HA-、HA-
H++A2-,下列四种溶液中c(A2-)最大的是( )
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
难度: 困难查看答案及解析
-
下列叙述中正确的是( )
A.甲苯中所有原子都处于同一平面
B.能与NaOH溶液反应且分子式为C2H4O2的有机物一定是乙酸
C.(CH3)2C=CHCH2CH3分子中的六个碳原子中至少有五个在同一平面上
D.间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
难度: 中等查看答案及解析
-
从化学成分上讲,油脂属于酯类化合物,对于油脂和酯类化合物认识正确的是( )
A.油和脂肪都属于酯类化合物,所以油和脂肪的结构相似
B.酯类化合物不是高分子化合物,自然界中的油脂是混合物,以甘油三酯为主要成分
C.酯类化合物是高分子化合物,自然界中的油脂是纯净物,以甘油三酯形式存在
D.油脂属于酯类化合物,天然油脂是纯净物,没有固定熔、沸点
难度: 简单查看答案及解析
-
下列实验中,能证明苯酚的酸性极弱的是 ( )
A.跟氢氧化钠溶反应生成苯酚钠 B.苯酚在空气中容易被氧化为粉红色
C.二氧化碳通入苯酚溶液能游离出苯酚 D.常温下苯酚在水中溶解度不大
难度: 简单查看答案及解析
-
制备乙酸乙酯的绿色合成路线之一为:
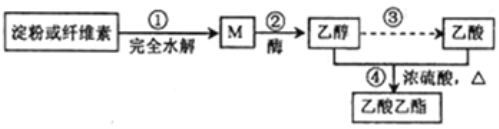
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
难度: 中等查看答案及解析
-
已知某些饱和一元醇的沸点(℃)如下表所示:
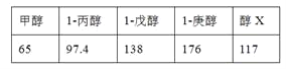
则醇X可能是( )
A.乙醇 B.丁醇 C.己醇 D.辛醇
难度: 中等查看答案及解析
-
已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成
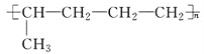 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )A.
 B.
B.
C.CH3CH2CH2Cl D.

难度: 中等查看答案及解析
-
下列物质中,能和NaOH溶液反应也能遇FeCl3溶液呈紫色的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列有关氟氯代烷的说法中,不正确的是( )
A.氟氯代烷化学性质稳定,有毒
B.氟氯代烷是一类含氟和氯的卤代烃
C.氟氯代烷大多无色、无臭、无毒
D.在平流层中,氟氯代烷在紫外线照射下,分解产生的氯原子可引发损耗臭氧的循环反应
难度: 中等查看答案及解析
-
由短周期前10号元素组成的物质T和X,如图所示的转化。X不稳定,易分解。为使得下列转化能够成功进行,方框内不可能加入的反应试剂是 ( )

A.Ag(NH3)2OH B.溴水
C.酸性KMnO4溶液 D.NaOH溶液
难度: 中等查看答案及解析
-
绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是
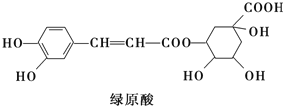
A.分子中所有的碳原子均可能在同一平面内
B.1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2
C.1mol绿原酸与足量NaOH溶液反应,最多消耗4mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
冰箱制冷剂氟氯甲烷在高空受紫外线辐射时产生Cl原子,并能发生下列反应:Cl+O3→ClO+O2 ClO+O→Cl+O2,下列说法不正确的是( )
A.反应过程中将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子起分解O3的作用
难度: 中等查看答案及解析