-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO4>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
难度: 中等查看答案及解析
-
生物炼铜实际上是微生物帮助我们从矿石中提取铜。这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化成可溶性铜的化合物,该化合物是( )
A.碳酸铜 B.硝酸铜 C.硫酸铜 D.氢氧化铜
难度: 简单查看答案及解析
-
下列关于实验安全的说法正确的是
A.开始蒸馏时,应该先加热再通冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
B.蒸馏时加碎瓷片的目的是防止暴沸
C.不慎把浓硫酸洒到皮肤上要立即用氢氧化钠溶液冲洗
D.盛放盐酸的试剂瓶上要贴上如图的标识

难度: 简单查看答案及解析
-
在剧烈运动或过热出汗后,及时补充电解质对保持健康很重要,下列关于电解质的说法错误的是
A.酸、碱、盐都是电解质
B.电离时产生的阴离子只有OH-的电解质是碱
C.在水溶液中或熔融状态下能导电的化合物是电解质
D.由于氧化钠溶于水生成钠离子和氢氧根离子,因而氧化钠是电解质
难度: 简单查看答案及解析
-
下列变化中需加入氧化剂才能实现的是
A.KMnO4→O2 B.Cl-→Cl2 C.Fe3+→Fe2+ D.H2SO4→CuSO4
难度: 简单查看答案及解析
-
下列各组离子,在无色透明溶液中能大量共存的是
A.NH4+、Mg2+、SO42-、Cl- B.Na+、H+、SO32-、Cl-
C.Na+、Cu2+、SO42-、OH- D.Na+、Ca2+、Cl-、CO32-
难度: 简单查看答案及解析
-
下列组合正确的是
纯净物
混合物
电解质
非电解质
A
氨水
水煤气
NaCl
酒精
B
氢氧化钡
蔗糖溶液
冰醋酸
三氧化硫
C
明矾
石灰水
KOH
盐酸
D
硫酸
钛合金
氯化钠
氮气
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某国外化学教材中有一张关于氧化还原反应的插图(如图),由图可知
在该反应中

A.作还原剂 B.被还原 C.发生还原反应 D.是还原产物
难度: 简单查看答案及解析
-
下列各组物质混合后,有气体生成,最终无沉淀生成的是
①金属钠投入到FeCl3溶液中 ②金属镁投入到盐酸中 ③NaOH溶液和CuSO4溶液 ④金属铝投入NaOH溶液中
A.①② B.②④ C.③④ D.①③④
难度: 中等查看答案及解析
-
将饱和FeCl3溶液加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是
A.溶液和胶体的本质区别是能否产生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1NA
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明来区别溶液和胶体
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
①三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
②碳酸镁与稀硫酸:MgCO3+2H+=H2O+CO2↑+Mg2+
③醋酸与大理石:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
④Fe2+与H2O2(酸性):2Fe2++H2O2+2H+=2Fe3++2H2O
⑤钠与CuSO4溶液:2Na+Cu2+=2Na++Cu
⑥碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
A.①③④⑥ B.②③④ C.②③④⑥ D.①③④⑤
难度: 中等查看答案及解析
-
下列说法错误的是
A.钠露置在空气中最后所得产物为Na2CO3
B.镁在空气中可形成一薄层致密的氧化膜,故镁不需要进行特殊保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.金属钠着火时,用细沙覆盖灭火
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,则下列叙述中正确的是
A.6.02×1022个NaHSO4分子在水中可电离生成NA个H+
B.在0℃、101 kPa时,22.4 L氯气中含有NA个氯原子
C.12 g 12C中所含碳原子数即为NA
D.0.1 NA个NaOH溶于1 L水所得溶液的物质的量浓度为0.1 mol·L-1
难度: 简单查看答案及解析
-
镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
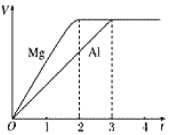
A.二者物质的量之比为3:2
B.二者质量之比为2:3
C.二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等
D.二者消耗H2SO4的物质的量之比为2:3
难度: 中等查看答案及解析
-
下列反应中水既不做氧化剂,又不做还原剂的氧化还原反应是
A.CaO+H2O=Ca(OH)2 B.Cl2+H2O=HCl+HClO
C.2Na+2H2O=2NaOH+H2↑ D.C+H2O=CO+H2
难度: 简单查看答案及解析
-
下图配制450mL1.00 mol·L-1 NaOH溶液的示意图,下列说法正确的是
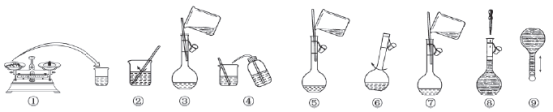
A.图①中应称得NaOH 18.0 g
B.未进行④和⑤的操作,所配溶液浓度将偏大
C.定容后把容量瓶倒置摇匀,发现液面低于刻度线不必再加水至刻度线
D.步骤②后应将溶液立即转移到容量瓶中,防止药品变质
难度: 中等查看答案及解析
-
量取8.0mL 5.0 mol•L-1 H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。下列说法正确的是
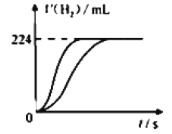
A.稀释后H2SO4溶液的物质的量浓度为0.04 mol•L-1
B.加入Fe的质量至少有0.56 g
C.反应过程中铁粉过量
D.金属Zn与硫酸反应转移电子数为0.01NA
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.若生成2.24 L HF,则转移0.4 mol电子 B.HF是氧化产物
C.O2F2既是氧化剂又是还原剂 D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的
A.分子数和气体物质的量均不同 B.分子数和质量均相同
C.分子数、原子数均相同 D.质子数和电子数均相同
难度: 简单查看答案及解析
-
某溶液中大量存在以下五种离子:MnO4-、SO42-、Fe3+、Na+、R,它们的物质的量之比为n(MnO4-):n(SO42-):n(Fe3+):n(Na+):n(R)=2:2:1:1:1,则R可能
A.Mg2+ B.Fe2+ C.CO32- D.K+
难度: 中等查看答案及解析
-
某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是

A.随着反应的进行,溶液中的H+浓度减小 B.反应的氧化剂是NO3-
C.消耗1 mol氧化剂,转移电子6NA D.氧化性:Cr2O72->NO3-
难度: 中等查看答案及解析
-
将0.1 mol NaOH和0.05 mol Na2CO3混合并配成溶液,向溶液中逐滴滴加0.5 mol/L稀盐酸,下列图象能正确表示加入盐酸的体积与生成CO2的体积(标准状况)的关系的是
A.
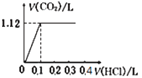 B.
B.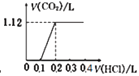
C.
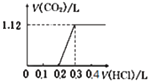 D.
D.
难度: 中等查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A. (b-a)/V mol·L-1 B.(2b-a)/V mol·L-1
C.2(2b-a)/V mol·L-1 D.2(b-a)/V mol·L-1
难度: 中等查看答案及解析