-
“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝、帛的使用有着悠久的历史,下列说法错误的是 ( )
A.丝的主要成分属于天然有机高分子化合物,丝绸制品不宜使用含酶洗衣粉洗涤
B.《墨子·天志》中记载“书之竹帛,镂之金石”。其中的“金”指的是金属,“石”指的是陶瓷、玉石等
C.《考工记》载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体来洗涤丝、帛。这种液体能洗涤丝、帛主要是因为其中含有K2CO3
D.《天工开物》记载“人贱者短褐、臬裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为臬、麻、苘、葛……”文中的“臬、麻、苘、葛”属于纤维素
难度: 中等查看答案及解析
-
芳香族化合物苯等在ZnCl2存在下,用甲醛和极浓盐酸处理,发生氯甲基化反应,在有机合成上甚为重要。下列有关该反应的说法正确的是 ( )
+HCHO+HCl
+H2O
A.有机产物A的分子式为C7H6Cl
B.有机产物A分子中所有原子均共平面
C.反应物苯是煤干馏的产物之一,是易挥发、易燃烧、有毒的液体
D.有机产物A的同分异构体(不包括自身)共有3种
难度: 中等查看答案及解析
-
用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
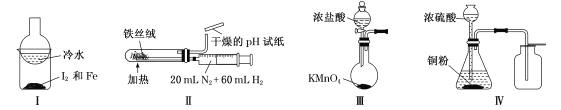
A.加热装置I中的烧杯分离I2和Fe B.利用装置Ⅱ合成氨并检验氨的生成
C.利用装置Ⅲ制备少量的氯气 D.利用装置Ⅳ制取二氧化硫
难度: 中等查看答案及解析
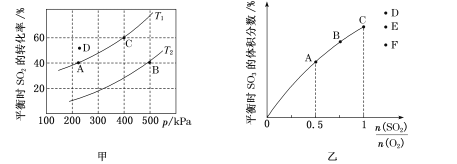
-
工业上可在高纯度氨气下,通过球磨氢化锂的方式合成高纯度的储氢材料氨基锂,该过程中发生反应:LiH(s)+NH3(g)=LiNH2(s)+H2 (g)。如图表示在0.3 MPa下,不同球磨时间的目标产物LiNH2的相对纯度变化曲线。下列说法正确的是 ( )
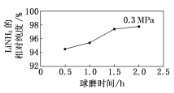
A.工业生产中,在0.3 MPa下合成LiNH2的最佳球磨时间是2.0 h
B.投入定量的反应物,平衡时混合气体的平均摩尔质量越大,LiNH2的相对纯度越高
C.在0.3 MPa下,若平衡时H2的物质的量分数为60%,则该反应的平衡常数K=1.5
D.LiH和LiNH2都能在水溶液中稳定存在
难度: 中等查看答案及解析
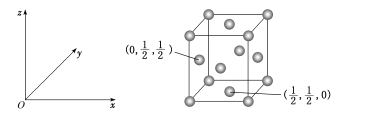
-
化合物ZYX4是在化工领域有着重要应用价值的离子化合物,电子式如图所示。X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为金属元素,X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )
A.Z是短周期元素中金属性最强的元素
B.Y的最高价氧化物对应水化物呈弱酸性
C.X、Y可以形成分子式为YX3的稳定化合物
D.化合物ZYX4有强还原性
难度: 中等查看答案及解析
-
室温下,向20 mL0.1 mol/L H2A溶液中逐滴加入0.1 mol/L NaOH溶液,H2A溶液中各粒子浓度分数δ(X)随溶液pH变化的关系如图所示。下列说法错误的是 ( )
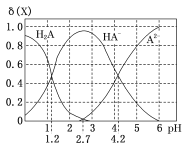
A.当溶液中A元素的主要存在形态为A2-时,溶液可能为弱酸性、中性或碱性
B.当加入NaOH溶液至20 mL时,溶液中存在((Na+)=2c(A2-)+c(HA-)
C.室温下,反应A2-+H2A=2HA-的平衡常数的对数值lgK=3
D.室温下,弱酸H2A的第一级电离平衡常数用Ka1表示,Na2A的第二级水解平衡常数用Kh2表示,则Kal>Kh2
难度: 中等查看答案及解析
-
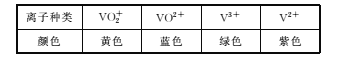
全钒液流储能电池是一种新型的绿色环保储能系统(工作原理如图,电解液含硫酸)。该电池负载工作时,左罐颜色由黄色变为蓝色。
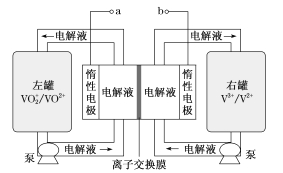
 4
4下列说法错误的是
A.该电池工作原理为VO2++VO2++2H+
VO2++V3++H2O
B.a和b接用电器时,左罐电动势小于右罐,电解液中的H+通过离子交换膜向左罐移动
C.电池储能时,电池负极溶液颜色变为紫色
D.电池无论是负载还是储能,每转移1 mol电子,均消耗1 mol氧化剂
难度: 中等查看答案及解析

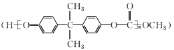 其合成路线如下:
其合成路线如下: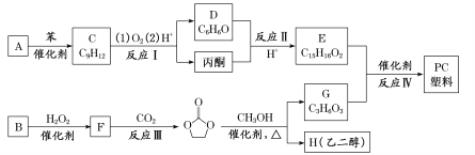
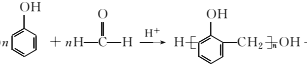 +(n-1)H2O
+(n-1)H2O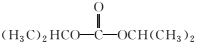 ,无机试剂任选,写出合成路线__________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,无机试剂任选,写出合成路线__________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。