-
《梦溪笔谈》中记载:“解州盐泽.....卤色正赤,在版泉之下,俚俗谓之“蚩尤血’。.....唯巫咸水入,则盐不复结,故人谓之‘无咸河.....原其理,盖巫咸乃浊水,入卤中,则淤淀卤脉,盐遂不成,非有他异也”。下列有关说法正确的是
A.“卤色正赤”的原因为水中含有Fe2+
B.“巫咸水乃浊水”指巫咸水是悬浊液
C.“巫咸水入卤中”发生了胶体的聚沉.
D.解州盐泽带负电荷,巫咸水带正电荷
难度: 中等查看答案及解析
-
化合物a(
)、b(
)、c(
)属于三类不同的环烷烃,下列说法不正确的是( )
A.a、b互为同分异构体
B.b能发生取代反应和氧化反应
C.c的一溴代物有5种(不考虑立体异构)
D.a、b、c中只有a的所有碳原子可能处于同一平面
难度: 中等查看答案及解析
-
证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理不相符的是( )
A.向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律
B.常温常压下,1体积CH4完全燃烧消耗2体积O2——阿伏加德罗定律
C.向Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深——勒夏特列原理
D.通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律
难度: 简单查看答案及解析
-
厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,腐蚀图解如图所示。下列说法正确的是( )
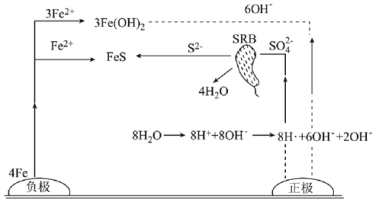
A.正极的电极反应式为8H++8e-=8H·(吸附)、SO42-+8H·(吸附)
S2-+4H2O
B.正极区溶液的pH变小
C.生成1molFeS,转移6mol电子
D.若引入新细菌,一定会加速金属的腐蚀
难度: 困难查看答案及解析
-
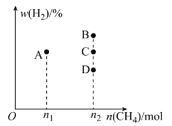
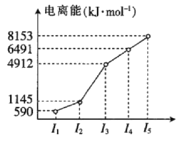
短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
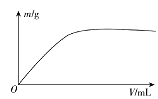
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1的AgNO3溶液分别滴定体积均为50.0mL的由Cl-与Br-组成的混合溶液和由C1-与I-组成的混合溶液(两混合溶液中Cl-浓度相同,Br-与I-的浓度也相同),其滴定曲线如图所示。已知25℃时:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=4.9×10-13,Ksp(AgI)=8.5×10-16。
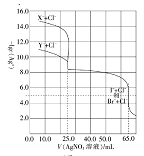
下列有关描述正确的是( )
A.图中X-为Br-
B.混合溶液中n(Cl-):n(I-)=8:5
C.滴定过程中首先沉淀的是AgCl
D.当滴入AgNO3溶液25mL时,Cl-与Br-组成的混合溶液中c(Ag+)=7×10-7mol·L-1
难度: 困难查看答案及解析
-
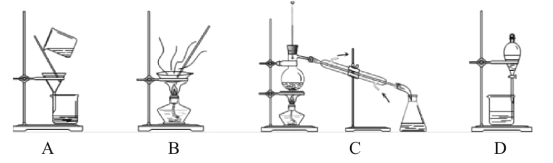
下列实验及现象不能得出相应结论的是( )
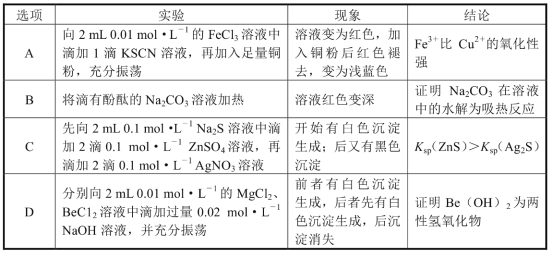
A.A B.B C.C D.D
难度: 中等查看答案及解析
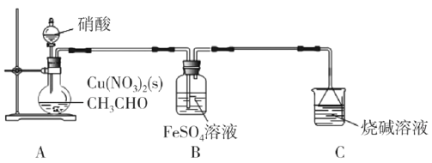
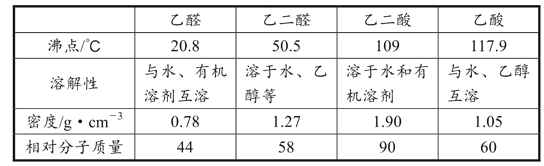
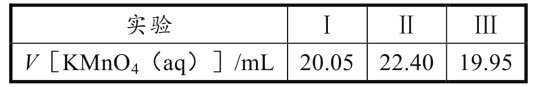
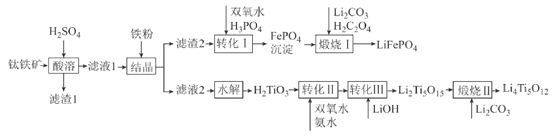
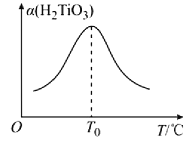
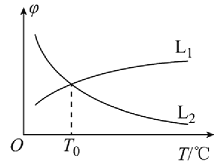
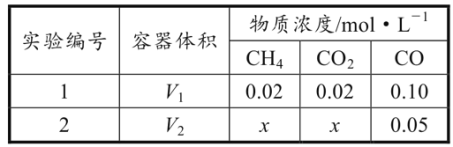
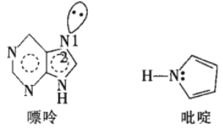
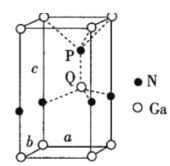
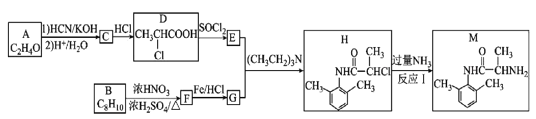
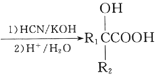 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)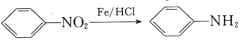 (-NH2易被氧化)
(-NH2易被氧化)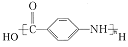 的合成路线:__。
的合成路线:__。