-
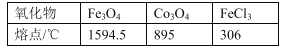
下列有关垃圾分类说法错误的是
A.废弃的聚乙烯塑料属于白色垃圾,不能使溴水退色
B.可回收的易拉罐中含金属铝,可通过电解氧化铝制取
C.废旧电池中含有镍、镉等重金属离子,不能填埋处理
D.含丝、毛的废旧衣物燃烧处理时只生成CO2和H2O
难度: 中等查看答案及解析
-
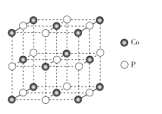
螺环化合物
可用于制造生物检测机器人,下列有关该化合物的说法错误的是
A.分子式为C5H8O
B.是环氧乙烷
的同系物
C.一氯代物有2种(不考虑空间异构)
D.所有碳原子不处于同一平面
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列说法正确的是
A.常温下,1 L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
B.常温下,10 mL 5.6 mol/L FeC13溶液滴到100 mL沸水中,生成胶粒数为0.056NA
C.向Na2O2通入足量的水蒸气,固体质量增加bg,该反应转移电子数为
D.6.8 g KHSO4晶体中含有的离子数为0.15 NA
难度: 中等查看答案及解析
-
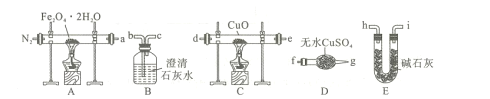
实验室制备少量乙酸乙酯的装置如图所示。下列有关该实验说法正确的是
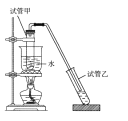
A.乙酸乙酯的沸点小于100℃
B.反应前,试管甲中先加入浓硫酸,后加入适量冰酸醋和乙醇
C.试管乙中应盛放NaOH浓溶液
D.实验结束后,将试管乙中混合液进行蒸发结晶可得到乙酸乙酯
难度: 中等查看答案及解析
-
一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
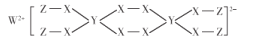
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
难度: 中等查看答案及解析
-
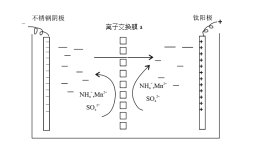
我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置如图所示。下列叙述错误的是
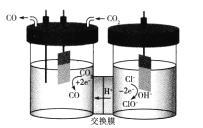
A.理论上该转化的原子利用率为100%
B.阴极电极反应式为
C.Na+也能通过交换膜
D.每生成11.2 L(标况下)CO转移电子数为NA
难度: 中等查看答案及解析
-
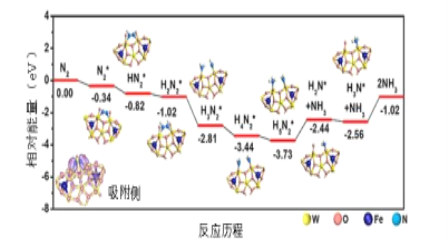
己知:
;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
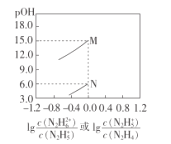
A.曲线M表示pOH与1g
的变化关系
B.反应
的
C.pOH1>pOH2
D.N2H5Cl的水溶液呈酸性
难度: 中等查看答案及解析