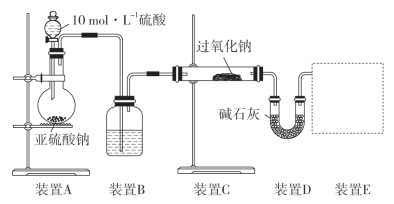
-
化学与生产、生活、社会密切相关,下列说法正确的是
A. 漂白粉长期放置在空气中会被空气中的氧气氧化而变质
B. 二氧化硫可用作葡萄酒的食品添加剂
C. 通讯领域中的光导纤维可长期浸泡在强碱性溶液中
D. 汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.1.4 g乙烯和丙烯混合气体中含有C—H键的数目为0.2NA
B.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA
C.标准状况下,11.2 L CO2与足量Na2O2反应,转移的电子数为NA
D.若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等。下列说法中一定正确的是
A.X的原子半径比Y的原子半径大
B.X形成的氢化物分子中不含非极性键
C.Z、W的最高价氧化物对应的水化物是酸
D.Y单质与水反应,水可能作氧化剂也可能作还原剂
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示
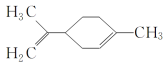 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
难度: 中等查看答案及解析
-
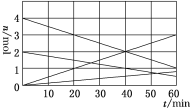
有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
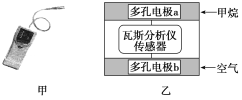
下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池外电路中电流由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+5O2--8e-=CO32—+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D.0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析
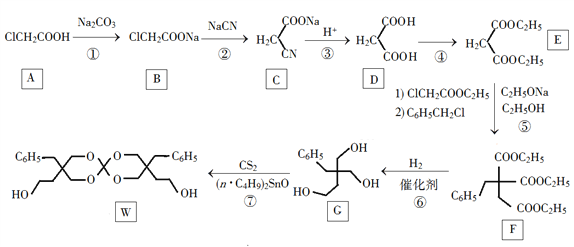
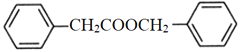 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。