-
中国历史文化对人类文明贡献巨大。下列说法正确的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.宋·王希孟《千里江山图》所用纸张为宣纸,其主要成分是碳纤维
C.《本草纲目》:“用浓酒和糟入甑,蒸令气上,用器承滴露”,涉及到了干馏
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法错误的是( )
A.将6.4gSO2溶于水,溶液中H2SO3、HSO3-、SO32-的个数之和为0.1NA
B.
和
的混合物中所含阴离子
总数为0.1NA
C.19.2g铜完全溶于一定浓度的硝酸中,转移电子数一定为0.6NA
D.标准状况下,
和
的混合气体中所含氢原子数为3NA
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
①常温下pH=1的溶液中:
②
溶液:
③中性透明溶液中:
④加入Al能放出H2的溶液中:
⑤能使红色石蕊试纸变为蓝色的溶液:
⑥25℃时
的溶液:
A.②③ B.①⑥ C.③④⑤ D.①⑤⑥
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析:
①氯化钠固体和氯化氢气体都不导电是因为二者中都不存在离子
②碳酸钠、氢氧化钡、氯化铵都属于离子化合物
③醋酸、烧碱和过氧化钠分别属于酸,碱和碱性氧化物
④氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
⑤碳酸钠晶体在空气中风化是化学变化,硫酸铜溶液导电是化学变化
⑥用玻璃棒蘸取溶液进行焰色反应实验,火焰呈黄色说明溶液中含有
⑦用
溶液、品红试液都可以区分CO2和SO2这两种气体
上述说法正确的是( )
A.①④⑤⑥ B.②④⑦ C.①②③⑤ D.②④⑤⑦
难度: 中等查看答案及解析
-
下列实验现象、结论或解释与实验操作相匹配的是
选项
实验操作
实验现象
结论或解释
A
向某待测溶液中滴加几滴新制氨水,振荡,再加入少量KSCN溶液
溶液变为红色
待测溶液中一定含有Fe2+
B
将SO2通入紫色石蕊溶液中
溶液先变红后褪色
SO2具有漂白性
C
向2mLKI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液
溶液呈蓝色
Br2的氧化性比I2的强
D
向某待测溶液中加入稀盐酸酸化的BaCl2溶液
有白色沉淀产生
待测溶液中一定含有SO42-
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
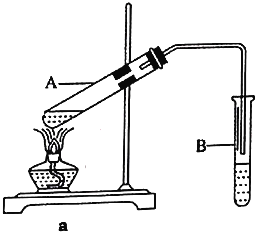
Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
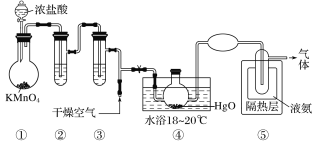
已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O。
下列说法中不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
难度: 中等查看答案及解析
-
工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+
O2(g)
CO(g) ∆H4=-111kJ/mol
②H2(g)+
O2(g)=H2(g) ∆H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) ∆H2=-394kJ/mol
下列说法不正确的是( )
A.25℃时,
B.增大压强,反应①的平衡向逆反应方向移,平衡常数K减小
C.反应①达到平衡时,每生成
的同时生成0.5molO2
D.反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
难度: 中等查看答案及解析
-
在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
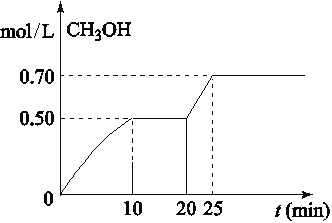
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
难度: 中等查看答案及解析
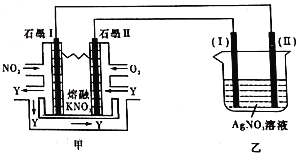
-
工业上用发烟
,把潮湿的
氧化为棕色的烟
来除去
,
中部分氯元素转化为最低价态。下列说法不正确的是( )
A.
属于强酸,
中Cr元素显
价
B.该反应除生成
外,还生成了另一种强酸
C.该反应中,参加反应的
与
物质的量之比为1∶2
D.作氧化剂的
与参加反应的
物质的量之比为3∶16
难度: 困难查看答案及解析
-
硼酸(H3BO3)是一种重要的化工原料。工业上采用以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3。Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如下:

下列叙述错误的是
A.“溶浸”中产生的气体是氨气
B.“滤渣1”是SiO2
C.“过滤2”前,将溶液pH调节至3.5,目的是转化为硼酸沉淀
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
难度: 困难查看答案及解析
-
向1L含0.01molNaAlO2和
的溶液中缓慢通入二氧化碳,随
增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
选项
溶液中离子的物质的量浓度
A
0
B
0.01
C
0.015
D
0.03
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
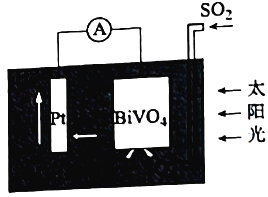
A.该电化学装置中,Pt电极作正极
B.
电极上的反应式为
C.Pt电极的电势高于
电极的电势
D.电子流向:Pt电极→导线→
电极→电解质溶液→Pt电极
难度: 中等查看答案及解析
-
下列四幅图示所表示的信息与对应的叙述相符的是
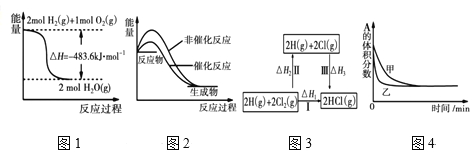
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol−1
B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D.图4表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
难度: 中等查看答案及解析
-
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
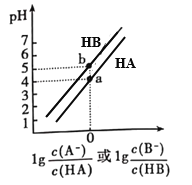
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
难度: 中等查看答案及解析
-
某温度下,
。向物质的量浓度相同的
和
的混合溶液中滴加
溶液产生
、
两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
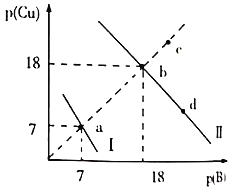
图中的
,
或
。下列说法错误的是( )
A.曲线Ⅰ表示的是Cu2+与OH-浓度关系的曲线
B.该温度下,
C.升高温度时,b点会向c点移动
D.向d点对应的溶液中加入对应阴离子的钠盐固体,d点向b点移动
难度: 困难查看答案及解析
-
足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12 L O2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
A.6.4 g B.9.6 g C.19.2 g D.24 g
难度: 困难查看答案及解析