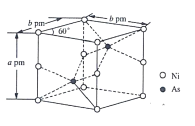
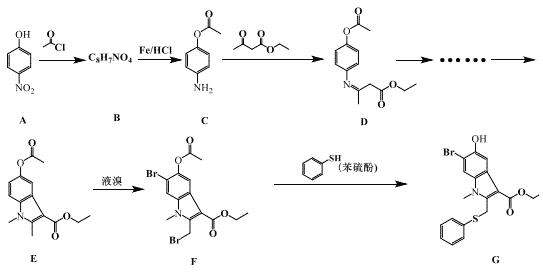
-
创建美好生态环境是实现“中国梦”的重要一环。下列做法正确的是
A.Na2O能与SO2反应,用Na2O作工业废气脱硫剂
B.FeS作沉淀剂去除工业废水中的重金属离子
C.将“84”消毒液与洁厕灵混合使用增强去污效果
D.将废旧电池进行深埋防止废旧电池对环境的污染
难度: 简单查看答案及解析
-
根据下列实验操作和现象能得出相应结论的是
选项
实验操作
现象
结论
A
将
缓慢通入滴有酚酞的NaOH溶液中
溶液红色褪去
具有漂白性
B
分别向盛有
溶液的a、b试管中滴加淀粉溶液和
溶液
a中溶液变蓝,b中产生黄色沉淀
能电离出
和
C
向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热
未见有银镜产生
淀粉没有水解
D
向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性
溶液
溶液紫色褪去
气体中含有乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是( )

A.四种元素简单离子半径比较:W>Y>Z>X
B.Y的氢化物与Y的最高价氧化物的水化物反应生成盐
C.X、Y、W组成的化合物中一定既有离子键又有极性键
D.W是所在周期中原子半径最小的元素
难度: 中等查看答案及解析
-
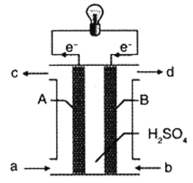
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是
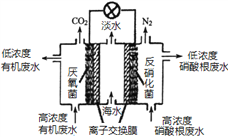
A.该电池能在高温下工作
B.该电池工作时,中间室中的Cl-移向右室
C.正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D.若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
难度: 中等查看答案及解析
-
炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是( )
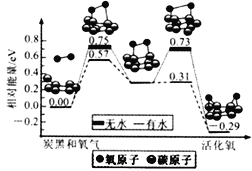
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
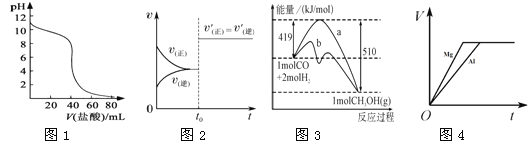
A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
难度: 中等查看答案及解析
-
25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )
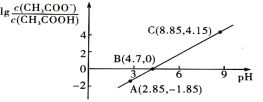
A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
难度: 中等查看答案及解析

 ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。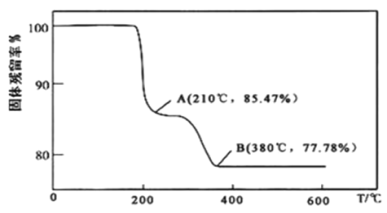
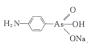 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。