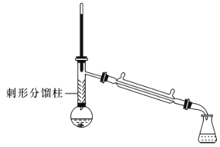
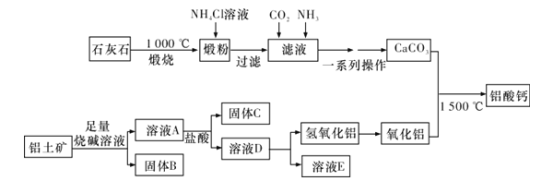
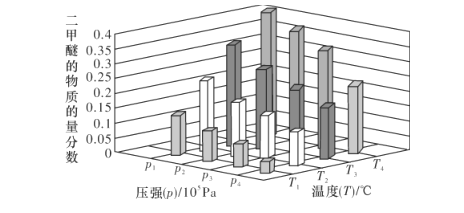
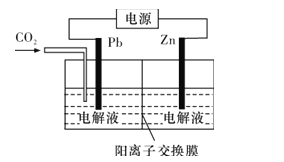
-
化学与生活密切相关。下列有关玻璃的叙述正确的是( )
A.含溴化银的变色玻璃,变色原因与太阳光的强度和生成银的多少有关
B.玻璃化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
C.钢化玻璃、石英玻璃及有机玻璃都属于无机非金属材料
D.普通玻璃的主要成分可表示为Na2O·CaO·6SiO2,说明玻璃为纯净物
难度: 简单查看答案及解析
-
关于化合物2-苯基丙烯酸乙酯(
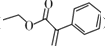 ),下列说法正确的是( )
),下列说法正确的是( )A.不能使稀酸性高锰酸钾溶液褪色
B.可以与稀硫酸或NaOH溶液反应
C.分子中所有原子共平面
D.易溶于饱和碳酸钠溶液
难度: 中等查看答案及解析
-
下列实验不能达到目的的是( )
选项
目的
实验
A
制取较高浓度的次氯酸溶液
将Cl2通入小苏打溶液中
B
除去溴苯中的少量溴
加入苛性钠溶液洗涤、分液
C
加快氢气的生成速率
将与稀硫酸反应的粗锌改为纯锌
D
制备少量氨气
向新制生石灰中滴加浓氨水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.含1mol/LC1-的NH4Cl与氨水的中性混合溶液中,NH4+数为NA
B.60gSiO2和28gSi中各含有4NA个Si-O键和4NA个Si-Si键
C.标准状况下,浓盐酸分别与MnO2、KClO3反应制备22.4LCl2,转移的电子数均为2NA
D.10g46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA
难度: 中等查看答案及解析
-
常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述正确的是( )
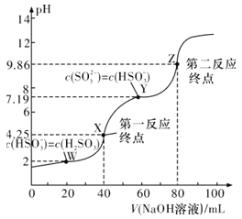
A.SO32-水解常数Kh的数量级为10-8
B.若滴定到第一反应终点,可用酚酞作指示剂
C.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
难度: 困难查看答案及解析
-
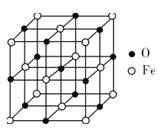
用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
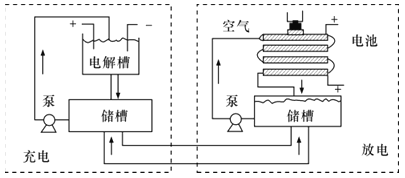
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
难度: 中等查看答案及解析
-
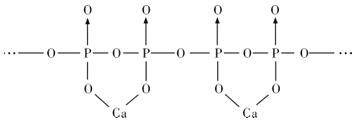
W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期。常温下,元素W与X可形成两种液态物质;Y、Z两种元素可组成二聚气态分子(如图所示),其中Y原子的最外层电子数等于其电子层数。下列叙述不正确的是( )
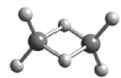
A.W与Z具有相同的负化合价
B.四种元素的简单离子半径由大到小的顺序:Z>Y>X>W
C.Y2Z6分子中所有原子的最外层均满足8电子稳定结构
D.工业上可电解X与Y形成的熔融化合物制取Y的单质
难度: 中等查看答案及解析
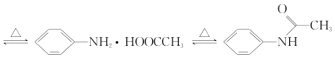 +H2O
+H2O