-
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
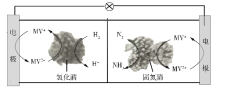
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
难度: 中等查看答案及解析
-
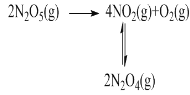
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
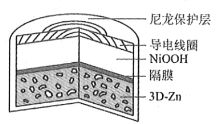
A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH−(aq)−2e−
ZnO(s)+H2O(l)
D. 放电过程中OH−通过隔膜从负极区移向正极区
难度: 困难查看答案及解析
-
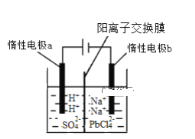
我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
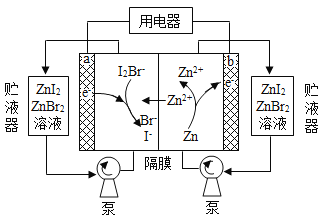
A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重
,溶液中有
被氧化
D. 充电时,a电极接外电源负极
难度: 中等查看答案及解析
-
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
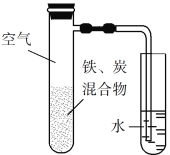
A. 铁被氧化的电极反应式为Fe−3e−
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
难度: 简单查看答案及解析
-
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.
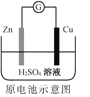 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.
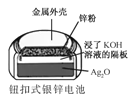 正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−
正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−C.
 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄D.
 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降难度: 困难查看答案及解析
-
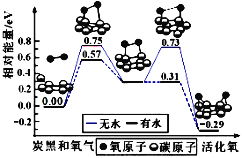
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
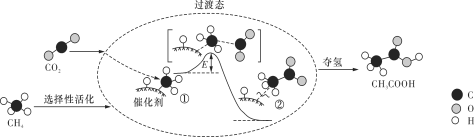
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
氢卤酸的能量关系如图所示下列说法正确的是
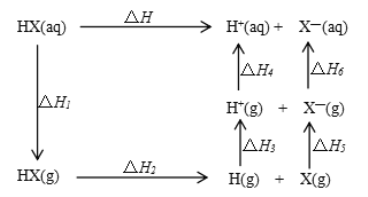
A.已知HF气体溶于水放热,则HF的△H1<0
B.相同条件下,HCl的△H2比HBr的小
C.相同条件下,HCl的△H3+△H4比HI的大
D.一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
难度: 中等查看答案及解析
-
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)
CH3OH(g)达到平衡状态.判断可逆反应达到平衡状态的标志是( )
A.υ生成(CH3OH)=υ消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.CO、H2、CH3OH的浓度相等
难度: 中等查看答案及解析
-
可逆反应3A(g)
3B+C ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( )
A.B和C可能都是气体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.有可能B为固体,C为气体
难度: 中等查看答案及解析
-
某密闭带活塞的容器中,反应达到平衡A(g)+2B(g)
3C(?),测得C(A)=0.6mol/L,将容积体积缩小为原来的一半并重新达到平衡,测得C(A)=1.0mol/L,下列说法正确的是
A.建立新平衡时,原平衡不移动 B.建立新平衡时,原平衡向左移动
C.C为非气体物质,加压时平衡向右移动 D.C为气体
难度: 中等查看答案及解析
-
已知298.15 K时,可逆反应:Pb2+(aq)+Sn(s)
Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
难度: 中等查看答案及解析
-
已知反应X(g)+Y(g)
nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
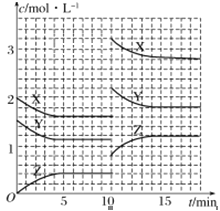
A.反应方程式中n=1
B.10min时,曲线发生变化的原因是升高温度
C.10min时,曲线发生变化的原因是增大压强
D.前5min后,用X表示的反应速率为v(X)=0.08mol·L-1·min-1
难度: 中等查看答案及解析
-
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
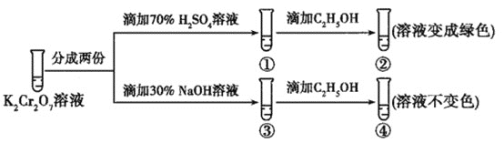
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
难度: 中等查看答案及解析
-
根据下列图示所得出的结论不正确的是
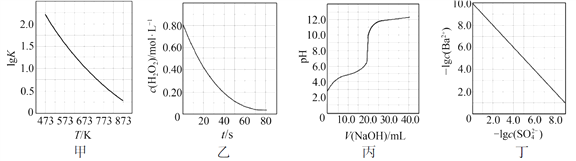
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析