-
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生
C.研发高效低毒的农药,降低蔬菜的农药残留量
D.积极开发废电池的综合利用技术,防止电池中的重金属等污染土壤和水体
难度: 简单查看答案及解析
-
下列有关化学用语表述正确的是
A.S2-的结构示意图:
B.CO2的比例模型:
C.邻羟基苯甲酸的结构简式:
D.质子数为79、中子数为118的金(Au)原子:11879Au
难度: 简单查看答案及解析
-
下列有关物质性质的应用正确的是
A.浓硫酸铵溶液能使蛋白质聚沉,可用来消毒杀菌
B.二氧化硅晶体具有高硬度,可用于制造通信光揽
C.二氧化硫具有还原性,微量二氧化硫可用于食品的抗氧化剂
D.锂质量轻、比能量大,可用作碱性KOH溶液电池负极材料
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol/LNH4I溶液中:Na+、Fe3+、Cl-、SO42-
B.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
C.与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3-
D.0.1mol/LNaHCO3溶液中:Na+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列说法正确的是
A.分子式为C4H10O的有机化合物一定是饱和一元醇
B.1molCl2通入足量水充分反应后转移的电子数为6.02×1023
C.H2O2具有氧化性,该性质可用于与酸性高锰酸钾溶液反应制取少量氧气
D.已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为CuSO4•5H2O(s)═CuSO4(s)+5H2O(l) △H=+Q1 kJ•mol-1.室温下,若1mol无水硫酸铜溶解为溶液放热Q2 kJ,则Q1>Q2
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O
B.醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+=Mg2++2H2O
C.用双氧水和稀硫酸处理印刷电路板:Cu +H2O2+2H+=Cu2++2H2O
D.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
短周期元素W、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍。Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体,下列说法正确的是
A.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
B.W的气态氢化物比X的稳定
C.XY2与ZY2中的化学键类型相同
D.Y的最高价氧化物对应水化物的酸性比W的强
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是

A.用图甲装置制取干燥的氨气
B.用图乙装置配制银氨溶液
C.用图丙装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
D.用图丁装置制取少量氧气
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.Na
Na2O2
NaI
B.
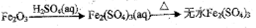
C.H2SiO3
SiO2
SiCl4
D.粗铜Cu
CuCl2(aq)
Cu
难度: 中等查看答案及解析
-
一种新型钠硫电池结构示意图如图,下列有关该电池的说法正确的是
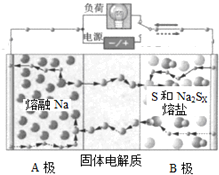
A.B极中填充多孔的炭或石墨毡,目的是为了增加导电性
B.电池放电时,A极电极反应为:2Na++xS+2e-=Na2SX
C.电池放电时,Na+向电极A极移动
D.电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子
难度: 中等查看答案及解析
-
下列图示与对应说法正确的是
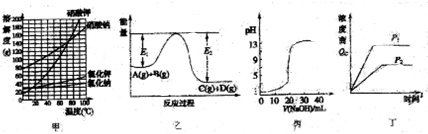
A.图甲表明利用NaNO3和KCl可能制取KNO3和NaCl
B.图乙表明反应A(g)+B(g)=C(g)+D(g)焓变大于零
C.图丙表示用0.1mol/LNaOH溶液滴定20mL0.1mol/L硫酸时混合溶液pH变化情况
D.图丁表示一定温度下反应N2(g)+3H2(g)
2NH3(g)在不同压强时浓度商(Qc)变化情况
难度: 中等查看答案及解析
-
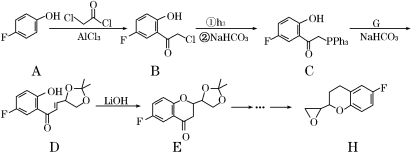
化合物C是制备液晶材料的中间体之一,它可由A和B在一定条件下制得
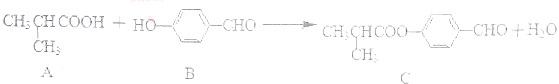
下列说法正确的是
A.每个A分子中含有1个手性碳原子
B.可以用酸性KMnO4溶液检验B中是否含有醛基
C.B、C各1mol分别和氢气反应,最多消耗氢气均为4molH2
D.C可发生加成反应、取代反应、氧化反应等
难度: 中等查看答案及解析
-
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
A.向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性
B.向该混盐中加入稀H2SO4可以产生使品红褪色的气体
C.该混盐在酸性条件下可以产生淡黄色浑浊
D.用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+
难度: 中等查看答案及解析
-
在常温下,下列有关溶液中微粒浓度关系的叙述正确的是
A.向0.1mol/LNH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量的NaClO、NaHCO5的溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+2c(CO32-)
C.向CH3COONa溶液中滴加稀HCl至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
D.等体积等物质的量浓度CH3COOH溶液和CH3COONa溶液混合:
2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
难度: 困难查看答案及解析
-
T1℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:X(g)+2Y(g)
3Z(g) 反应过程中测定的部分数据如下表:
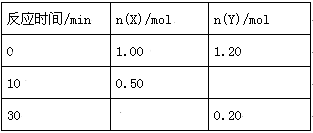
A.前10min内反应的平均速率为v(Z)=0.150 mol•L-1•min-1
B.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,平衡后气体Y的物质的量保持不变
C.保持其他条件不变,起始时向容器中充入0.50molX气体和0.60moY气体,到达平衡时X转化率大于上述条件X转化率
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
难度: 困难查看答案及解析
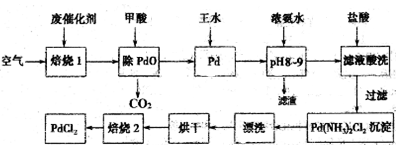
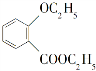 是一种重要的有机合成中间体,请写出以苯酚、乙醇和
是一种重要的有机合成中间体,请写出以苯酚、乙醇和