-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
核外电子数相等的原子一定是( )
①同种元素 ②同种原子 ③质子数相同 ④质量数相同⑤同位素
A.①②③ B.①③
C.①②③④ D.全部
难度: 简单查看答案及解析
-
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能一步实现的是( )
A.Si
SiO2
Si B.NO2
HNO3
NO2
C.Fe
FeCl3
Fe D.S
SO2
S
难度: 中等查看答案及解析
-
某溶液与Al反应能放出H2,下列离子在该溶液中可能能大量共存的是( )
A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42-
C.Ag+、K+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.小苏打中加入过量的澄清石灰水:Ca2+ +2OH- +2HCO3- = CaCO3 ↓ +2H2O+ CO32-
B.偏铝酸钠溶液中通入过量的CO2:CO2 +3H2O+2A1O2- = 2Al(OH)3↓十CO32-
C.Na2SO3 溶液使酸性 KMnO4溶液褪色:5SO32- + 6H++2MnO4-= 5SO42- + 2Mn2++ 3H2O
D.Fe(NO3)2 溶液中加入过量HI溶液:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
有以下六种溶液:①Ba(OH)2溶液;②Ba(NO3)2溶液;③KMnO4溶液;④品红试液;⑤Na2SiO3 溶液;⑥NaHCO3溶液,利用化学性质可用于区分CO2和SO2这两种气体的溶液有( )种
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
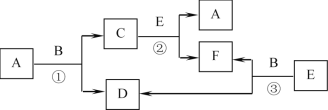
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是( )
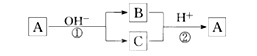
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A.铝钠合金的熔点低于组成金属
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.mg不同组成的铝钠合金投入足量盐酸中,若铝的质量分数越小,则放出的H2越多
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量
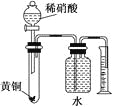
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
难度: 中等查看答案及解析
-
已知A、B、C、D、E是核电核数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,则下列推断中正确的是( )
A.A、D不可能属于同一族
B.A、B、E至少有两种元素在同一周期
C.C可能是金属元素也可能是非金属元素
D.C、D元素形成的简单离子可能具有相同的核外电子排布
难度: 中等查看答案及解析
-
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
编号
①
②
③
④
A中气体
H2S
H2
NH3
NO
B中气体
SO2
Cl2
HCl
O2
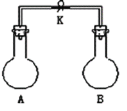
A.②③④① B.③①④②
C.③②①④ D.④③②①
难度: 中等查看答案及解析
-
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+、Na+、K+和C1-
难度: 中等查看答案及解析
-
现有mmolNO2和nmolNO组成的混合气体,欲用amol/LNaOH溶液吸收,使该混合气体全部转化成盐进入溶液,至少需要amol/LNaOH溶液的体积为( )
(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O)
A.
L B.
L C.
L D.
L
难度: 中等查看答案及解析
-
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A. 1∶1∶3 B. 1∶2∶4 C. 1∶1∶4 D. 1∶3∶1
难度: 困难查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
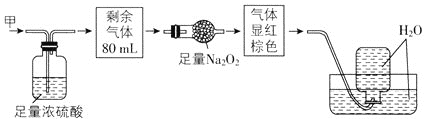
A.NO2、NH3、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
难度: 中等查看答案及解析
-
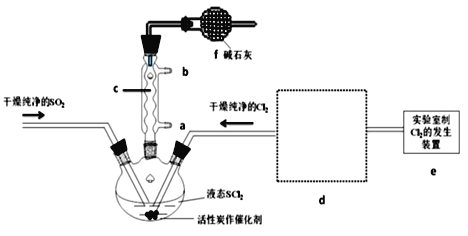
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6.72L O2,则被H2O还原的BrF3的物质的量为
A.0.3mol B.0.4mol C.0.6mol D.0.9mol
难度: 中等查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( )
A. 5 B. 3 C. 4 D. 2
难度: 中等查看答案及解析
-
将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO气体2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l ②c(HNO3)=0.5mol·L-l ③m=8.0 ④m=7.2。其中正确的是( )
A.①④ B.①③ C.②④ D.②③
难度: 中等查看答案及解析