-
在25.00 mL氢氧化钠溶液中逐滴加入0.2000 mol·L-1醋酸溶液,滴定曲线如图所示。
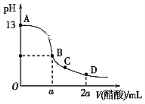
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________。
(2)该氢氧化钠溶液的物质的量浓度为_________mol·L-1。
(3)设在B点时酸碱恰好中和,则a=____________。
(4)若所加入的酸为0.2000 mol·L-1的盐酸,则D点时溶液的c(H+)=________。
难度: 中等查看答案及解析
在25.00 mL氢氧化钠溶液中逐滴加入0.2000 mol·L-1醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________。
(2)该氢氧化钠溶液的物质的量浓度为_________mol·L-1。
(3)设在B点时酸碱恰好中和,则a=____________。
(4)若所加入的酸为0.2000 mol·L-1的盐酸,则D点时溶液的c(H+)=________。
难度: 中等查看答案及解析
若用AG表示溶液的酸度,其表达式为: AG=lgc(H+)/c(OH-)。室温下,实验室里用0.1 mol/L的盐酸溶液滴定10mL0.1 mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是

A. 该流定过程可选择酚酞作为指示剂
B. 溶液中由水电离的c(H+): C点>D点
C. C点时加入盐酸溶液的体积等于10 mL
D. 若B点加入的盐酸溶液体积为5 mL,所得榕液中: c(M+) +c(H+)= c(MOH)+ c(OH-)
难度: 中等查看答案及解析
25℃时,用0.10mol/L的盐酸分别滴定体积相同且浓度均为0.10mol/L的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。
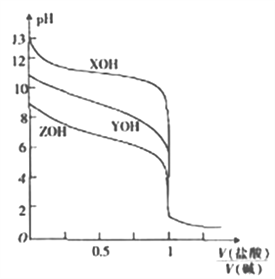
下列说法正确的是
A.滴定XOH时可用酚酞作指示剂
B.YOH是强碱
C.X++H2OXOH+ H+的平衡常数K=10-4
D.[V(盐酸)/V(碱)]=0.5时,c(Z+)>c(Y+)>c(X+)
难度: 中等查看答案及解析
298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
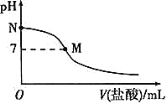
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(OH-)
D.N点处的溶液中pH<12
难度: 中等查看答案及解析
电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
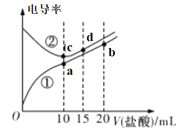
A.曲线①代表滴定氢氧化钠溶液的曲线
B.滴定氨水的过程应该选择酚酞作为指示剂
C.b点溶液中:c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O)
D.a、b、c、d四点的溶液中,水的电离程度最大的是c点
难度: 中等查看答案及解析
常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示,下列说法正确的是
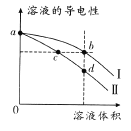
A.曲线II表示氨水加水稀释过程中溶液导电性的变化
B.溶液的pH 大小关系:c>b>d
C.若将bd两点溶液混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.由水电离出n(OH-):b>c
难度: 中等查看答案及解析
在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
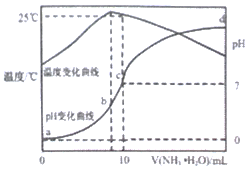
A.a点Kw=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
难度: 中等查看答案及解析
25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A.25℃时,H2A的第二步电离平衡常数约为10-6
B.水的电离程度:N>M>P
C.随着盐酸的不断滴入,最终溶液的pH小于2
D.P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
难度: 中等查看答案及解析