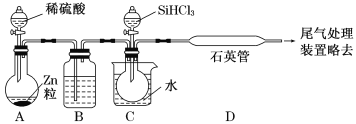
-
设NA为阿伏加德罗常数的数值,下列说法中不正确的是( )
A.1 mol OH−含8 NA个电子
B.1 mol CH4和CO2混合气体中含C原子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.标准状况下,64 g SO2中含有的原子数为3NA
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.同温同压下,1 mol N2与1 mol CO可能具有不同的体积
B.同温同压下,二氧化碳与笑气(化学式为N2O)的密度相同
C.质量相同的O2与O3,一定具有相同的原子数
D.28 g CO与1 mol CO一定具有相同的碳原子数
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B.用醋酸除水垢:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
C.向碳酸氢钠溶液加入盐酸溶液:H+ + CO32- + H+ = CO2↑ + H2O
D.向Al2(SO4)3溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
难度: 中等查看答案及解析
-
在无色透明溶液中,不能大量共存的离子组是( )
A.K+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.Ca2+、Na+、OH-、HCO3- D.Ba2+、Na+、OH-、NO3-
难度: 中等查看答案及解析
-
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法正确的是()
A.Cu3P既是氧化产物也是还原产物
B.11molP参与反应时,该反应中有15mol电子发生转移
C.P发生还原反应和氧化反应的物质的量之比为6∶5
D.CuSO4仅作氧化剂,发生还原反应
难度: 中等查看答案及解析
-
将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有白色沉淀产生的是( )
A.NaHCO3溶液 B.MgSO4溶液 C.FeCl3溶液 D.HCl溶液
难度: 中等查看答案及解析
-
对于反应:2Na2O2(s) + 2H2O(g) = 4NaOH(s) + O2(g),下列说法中正确的是( )
A.Na2O2是氧化剂,H2O是还原剂
B.O2既是氧化产物,又是还原产物
C.该反应中每生成1 mol O2时电子转移的数目为4 mol e-
D.18 g H2O(g)与足量Na2O2(s)反应,反应前后固体质量增加2 g
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是 ( )
①过量Ba(OH)2溶液和明矾溶液混合
②氯化钙溶液中通入少量的CO2
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入足量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
⑥Na2SiO3溶液中通入过量CO2
A.①③④⑥ B.②③④⑤ C.①②⑤⑥ D.②③④⑤
难度: 中等查看答案及解析
-
把NaOH和Na2CO3混和物配制成100mL溶液,其中c(Na+) =0.5mol/L。在该溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体质量为( )
A.2.925 g B.5.85 g C.6.56 g D.无法确定
难度: 中等查看答案及解析
-
现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )
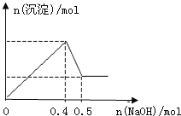
A.4∶3 B.1∶3 C.1∶4 D.2∶3
难度: 中等查看答案及解析
-
下列物质反应后一定有+3价铁生成的是( )
①过量的铁与氯气反应
②FeCl2溶液中通入少量Cl2
③铁与过量的稀硫酸反应
④铁和氧化铁的混合物溶于盐酸
A.① B.①② C.①②③ D.①②④
难度: 中等查看答案及解析
-
现有浓度均为1 mol/L的FeCl3、CuCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。已知,氧化性Fe3+> Cu2+下列有关叙述正确的是( )
A.反应后的溶液中n(Fe2+)是0.15 mol B.反应后的溶液中不存在Fe3+和Cu2+
C.反应后残留固体为3.2 g D.反应后残留固体中可能含有未反应的铁粉
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.SiO2既可以和NaOH溶液反应,也可以和HF溶液反应,所以SiO2是两性氧化物
B.向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C.石英是良好的半导体材料,可以制成光电池
D.陶瓷的烧制不涉及化学变化
难度: 中等查看答案及解析
-
下列有关氯气的叙述正确的是( )
A.氯气使湿润有色布条褪色,可证明氯气具有漂白性
B.将氯气通入石灰水可制得漂白粉
C.将Cl2制成漂白粉的主要目的是提高漂白能力
D.在常温下,溶于水的部分Cl2与水发生反应
难度: 中等查看答案及解析
-
把含有氧化铁的铁片投入到足量的稀盐酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3∶1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A.1∶1 B.1∶2 C.3∶5 D.2∶5
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是( )
A.参与反应的氯气为0.15 mol
B.溶液中氯离子的物质的量取值范围是0.10 < n(Cl-)< 0.25
C.n(Na+)∶n(Cl-)可能为15∶8
D.n(NaCl):n(NaClO)∶n(NaClO3)可能为8∶3∶1
难度: 中等查看答案及解析